タンパク質の動きや見えなかった水分子などの観測が可能に-SPring-8のデータを用いた、新しい構造解析法を開発-(プレスリリース)
- 公開日
- 2008年02月28日
- X線構造解析手法
平成20年2月28日
国立大学法人名古屋大学
独立行政法人理化学研究所
本研究成果のポイント
● MEMをタンパク質構造解析にもちいる新方法が出現
● SPring-8*1で得られたデータから、従来の手法では見えなかった結合電子、水分子、マルチコンフォーマーの観測
● 構造解析にもとづく薬とタンパク質の反応の解明への期待
|
国立大学法人名古屋大学(平野眞一総長)、独立行政法人理化学研究所(野依良治理事長)のグループは、名大で開発した新しいX線構造解析手法を、SPring-8で得たリン酸エステル加水分解酵素「putative acylphosphatase」の回折データの解析に利用し、これまで見ることができなかったタンパク質の動きを示す複数のマルチコンフォーマーやタンパク質を構成している多数の水分子、さらには水素結合などを可視化することに成功しました。これは、名大工学研究科の坂田誠教授、西堀英治准教授、青柳忍博士、理研放射光科学総合研究センター(石川哲也センター長)宮野構造生物物理研究室の宮野雅司主任研究員、吾郷日出夫専任研究員、理研中央研究所(茅幸二所長)戎崎計算宇宙物理研究室の戎崎俊一主任研究員らのグループによる研究成果です。今回の成果により、タンパク質など高分子の構造を実験から詳しく見る手法が開発されたこととなります。データの解析には、理研情報基盤センターのRSCCシステムのSX-7を活用しました。 (論文) |
1.背 景
タンパク質は、精緻で複雑な生命を直接支えており、多くの疾患はタンパク質の様々な働きの異常に起因しています。そのため、疾患に関連するタンパク質の構造に基づいて機能を解析することで、タンパク質の働きの制御が可能になり、働きを調整する化合物の最適化を画期的に展開でき創薬プロセスを大幅に改良できさらに短縮することが可能となります。
X線結晶構造解析は、タンパク質の構造を原子の配置位置として立体的に折り畳まれて働く形で3次元で決定する手法として広く用いられています。1962年にヘモグロビンとミオグロビンの初めてのタンパク質立体構造決定でノーベル化学賞を受賞したPerutzとKendrewの先駆的な業績以後、X線回折により3次元構造が明らかにされたタンパク質は着実に増加し、最近では、従来の実験室光源の1億倍のX線強度をもつSPring-8で得られるX線を用いることで、タンパク質の原子と原子の間の結合電子や分子と分子の間に広がって存在する水分子などの詳しい構造の情報を含んだX線回折データを短時間で測定することが可能になりました。計算機性能の進歩とさまざまなデータ解析法の開発により、原子の大まかな配列の解明は加速されてきていますが、SPring-8のデータに含まれる結合電子や結晶の半分近くを占める水分子の大半を詳しく見る方法は存在しませんでした。
2.研究成果
名大の坂田 誠教授の研究グループは、マキシマムエントロピー法(MEM)を用いた新しい構造解析の方法を開発し、SPring-8で得られたX線回折データからフラーレン、有機伝導体、超伝導体などの原子間の結合電子などの詳しい構造をMEM電子密度分布(MEMマップ)のかたちで可視化する方法で解明してきました。この方法をタンパク質構造解析に用いるために、理研放射光科学総合研究センター高田構造科学研究室の高田昌樹主任研究員と島根大学の田中宏志准教授が機能と効率を大幅に向上したMEM解析プログラムを開発しました。しかし、単にMEM解析を行うだけでは、タンパク質の結合電子や分子間の水分子を詳しく見ることは困難でした。
今回、坂田教授の研究グループは、条件を変えて計算した差MEMマップ、Omit-MEMマップなどの複数の種類のMEMマップを計算し、マップにあわせてタンパク質構造のモデルの修正を繰り返しました。このMEMマップによるモデル修正を従来のタンパク質の構造解析に効果的に組み込み、最終的に、これまでの方法では観ることが難しかったタンパク質中の水素結合(図1)やタンパク分子の間の水分子(図2)、さらにはタンパク質の動きやすい部分を示す多数のマルチコンフォーマー(図3)を観測することに成功しました。最終的に得た構造モデルのデータとの一致度を示す指標R、Rfreeは10%を下回りました。これは、タンパク質構造のデータベースに登録された50,000の構造の中でトップ0.2%に入る精度であることを示しています。
3.今後の期待
今回の成果は、開発した方法によって、SPring-8のX線回折データが含む構造情報を可能な限り引き出したことにより達成しました。複数の種類のMEMマップの計算には、理研情報基盤センターRSCCのSX-7システムおよび名大のSX-6iスーパーコンピュータが用いられました。通常1回あたり数時間以上を要するMEM計算の1,000回以上の繰り返しをこれらのスーパーコンピュータが可能にしました。
現在、SPring-8では、創薬のターゲットとなる多数のタンパク質のX線回折データ測定を行っています。今回の手法によって、創薬の決め手となる薬剤とタンパク質の反応を示す詳しい構造が、直接SPring-8のデータから観測でき、創薬プロセスがいっそう加速されることが期待されます。現状、MEM解析を繰り返し行うには計算時間が問題となりますが、理研が取り組んでいる次世代スーパーコンピュータの開発で、この問題も解決されていくことが期待されます。
《参考資料》
《用語解説》
*1 SPring-8
兵庫県の播磨科学公園都市にある世界最高の大型放射光施設。SPring-8の名前はSuper Photon ring-8GeVに由来する。放射光は、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げられたときに発生する、細く強力なX線のことである。SPring-8では、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。SPring-8は日本の先端科学・技術を支える高度先端科学施設として、日本国内外の大学・研究所・企業から年間一万人以上の研究者が利用している。現在は、独立行政法人理化学研究所が所有し、理研から委託を受けた財団法人高輝度光科学研究センター(JASRI)によって運営されている。(http://www.spring8.or.jp/ja/)
|
(問い合わせ先) (SPring-8に関する問い合わせ先) (報道担当) 独立行政法人理化学研究所 |
- 現在の記事
- タンパク質の動きや見えなかった水分子などの観測が可能に-SPring-8のデータを用いた、新しい構造解析法を開発-(プレスリリース)
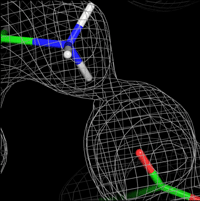 図1. 水素結合を示すMEMマップ
図1. 水素結合を示すMEMマップ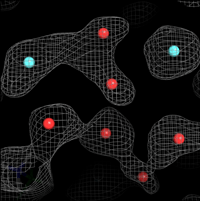 図2. タンパク質分子の間のMEMマップ
図2. タンパク質分子の間のMEMマップ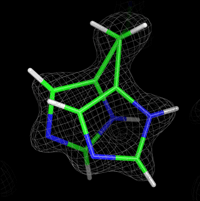 図3. マルチコンフォーマー構造のMEMマップ
図3. マルチコンフォーマー構造のMEMマップ