藍藻の「時計たんぱく質」が時を刻む機構を解明 - 時計を作る3つの歯車は時々刻々と組み合わせを変えながら回転する -(プレスリリース)
- 公開日
- 2008年03月14日
- BL45XU(理研 構造生物学I)
平成20年3月14日
科学技術振興機構(JST)
理化学研究所
名古屋大学
|
JST基礎研究事業の一環として、秋山修志(JSTさきがけ研究者)は、理化学研究所と名古屋大学と共同で、藍藻(らんそう)の生物時計を構成する3つの時計たんぱく質が結合や解離(離合集散)を繰り返しながら時を刻む仕組みを解明しました。 (論文) |
<研究の背景と経緯>
地球上の生命体の多くは精巧な生物時計を備えており、時計が発振する24時間周期のリズム(概日リズム)を指針に、代謝や光合成といった重要な生命活動を昼夜環境サイクルに同調させています。細菌から哺乳類に至る多様な生物について研究が行われ、現在では時計と病気のつがなりが分子レベルで解明されつつあります。例えば、ヒトの主要な時計たんぱく質に変異が生じると、日没後の耐え難い眠気、翌日未明の覚醒といった症状を呈することが知られています(睡眠相前進症候群)。この変異は時計たんぱく質の特定のアミノ酸がリン酸により修飾されるのを妨げるものであり、時計たんぱく質同士の相互作用やリン酸化制御といった生体高分子の織り成す複雑なネットワークの中に、“時計の本質(秩序ある生命現象)”が潜んでいることを示します。
藍藻は生物時計を備えた最も下等な生物で、その時計は3種類の時計たんぱく質(KaiA、KaiB、KaiC)で構成されています。時計の振り子に相当するのがKaiCで、その状態はKaiAやKaiBとの相互作用を通じて変化します。KaiAがKaiCのリン酸化を促すのに対し、KaiBはKaiAの働きを抑制することでKaiCの脱リン酸化を促します。実験室で精製した3つの時計たんぱく質とATPを混合すると、KaiCがリン酸化型と脱リン酸化型の間を概日周期で振動し、藍藻の生物時計を試験管内で再構成できることが名古屋大学の研究グループによって2005年に実証されています。
「たった3種類のKaiたんぱく質で安定に時を刻む」という驚くべき生命現象を解明するため、Kaiたんぱく質の詳細な立体構造を明らかにしようという研究が精力的に行われてきました。既に、各々のKaiたんぱく質の単独構造が解析されていますが、Kaiたんぱく質同士が結合した複合体構造は不明であるため、時計が動く仕組みを深く理解するには至っていません。その主たる理由は、KaiCがKaiAやKaiBと常に一定の結合状態を保っているのではなく、ときにKaiAと結合してリン酸化を促進させ、またときにはKaiBと結合して脱リン酸化を促すように、3種類のたんぱく質が作る複合体の大きさ・形が時間とともに変化する離合集散系であるためです。X線結晶構造解析や核磁気共鳴法といった従来の構造生物学的手法のみで、離合集散を伴う生命現象を解明することは容易なことではありません。そこで、本研究グループは、たんぱく質分子の形状変化を生理的な溶液中で計測することのできるX線小角散乱と呼ばれる手法を用いました。
<研究の内容>
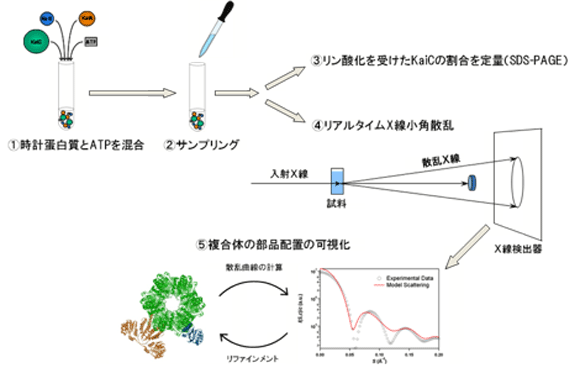
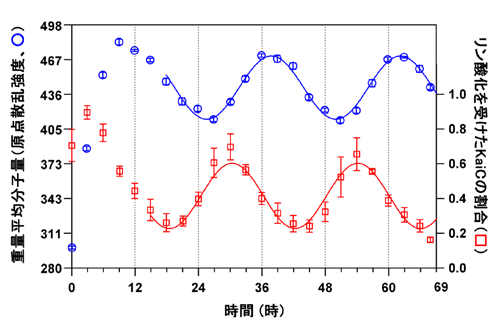
まず、3種のkaiたんぱく質KaiA、KaiB、KaiCをATPと混合し、振動反応を開始させます(時刻ゼロ)。各測定時刻に一定量の試料を反応溶液より抽出し、その一部を用いてリン酸化を受けたKaiCの割合(KaiCのリン酸化状態)を定量、残りをX線小角散乱による離合集散計測に使用し、理研構造生物学ビームラインI(BL45XU)で72時間の実時間・X線小角散乱測定を行いました(図1)。すると、入射ビームと同方向に散乱されたX線の強度(原点散乱強度)は約24時間の周期で力強く振動していました(図2)。この結果は、Kaiたんぱく質が溶液中で離合集散を繰り返していることを示すものです。
原点散乱強度と同様に、KaiCのリン酸化状態も24時間の周期で振動していました。興味深いのは、2つの波が山を迎える時刻(位相)が完全に一致しておらず、KaiCリン酸化状態が原点散乱強度よりも1/4周期進んでいる点です。位相差が生じた原因を突き止めるため、KaiAもしくはKaiBを欠損した系について同様の実験を行いました。その結果、KaiCと相互作用を形成するタイミングがKaiAとKaiBでは大きく異なっており、対照的であることが判明しました。3つのKaiたんぱく質を混合すると、KaiAは勢いよくスタートダッシュを切ってKaiCへと結合し、速やかにKaiCをリン酸化します(KaiCリン酸化状態のピーク)。KaiBはリン酸化が終了した頃合に遅れてやってきてKaiCと結合し(複合体形成による原点散乱強度のピーク)、ゆっくりと脱リン酸化しつつKaiCから解離します。このように俊敏に機能するKaiAの後に、ゆっくりではあるけれども確実にKaiBが機能するために位相差が生じます。
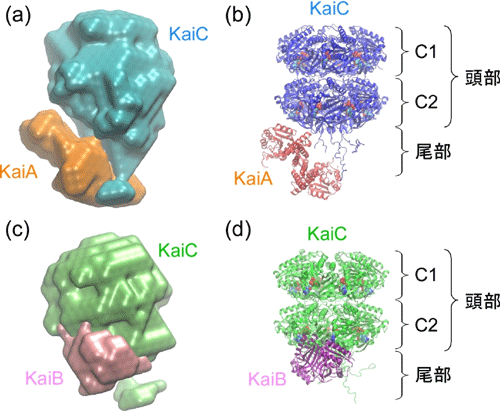
さらに、離合集散の過程で一時的に蓄積するKaiAC複合体やKaiBC複合体の分子形状を調べることに成功しました(図3)。KaiAC複合体は150×150×110オングストロームの大きさからなります。KaiCは全体積の80%を占め[図3(a)・青色]、球状の頭部と短い尾部から構成されていました。頭部の中心には空洞が存在しており、すでに論文発表済みのKaiC結晶構造を一意的に当てはめることができました[図3(b)]。KaiCの頭部は更にC1とC2と呼ばれるドメインに分割され、KaiAに相当する残り20%の電子密度[図3(a)・オレンジ色]はC2ドメインと尾部近傍に局在化していました。一方、KaiBC複合体は140×130×100オングストロームの寸法からなり、その全体構造はKaiAC複合体よりもわずかにコンパクトでした。KaiAC複合体と同様にKaiCに特徴的な形状[図3(c)・緑色]を確認することができ、全体の13%の体積を占めるKaiBはC2ドメインと相互作用していることが理解されます[図3(d)]。
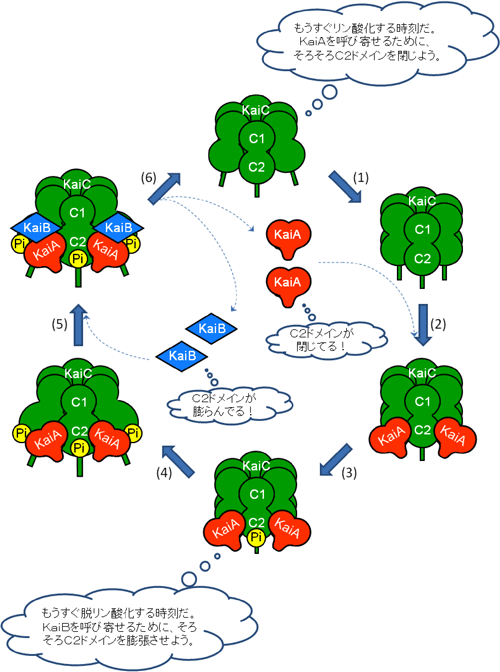
強調したいことは、本研究で時を刻む歯車の噛み合わせが可視化されただけでなく、解明した複合体構造からどの歯車が時を刻むための駆動力(ペースメーカー)となっているかを読み取れる点です。図3が示すように、KaiAやKaiBはKaiCのC2ドメインや尾部と相互作用しています。リン酸化を受けるアミノ酸はKaiCのC2ドメインに局在化しており、またKaiCの尾部の根元は時計を駆動するエネルギー源であるATP分子の近傍に固定されています。従って、これらの複合体構造はKaiCが自身のリン酸化状態に応じたC2ドメイン~尾部の構造変化によってKaiAやKaiBを呼び寄せたり(結合)、また突き放したり(解離)しながら離合集散タイミングを制御するのに最適な部品配置であるといえます(図4)。また別の実験から、時計の振動周期が生理学的な範囲で溶媒の粘度に依存しないことも判明、Kaiたんぱく質分子が溶液中で行き来する過程が周期の決定因子ではないことを発見しました。これらの結果はKaiCがペースメーカーの役割を担うことを示しており、ノイズの多い込み入った細胞内で時計の針を正確に進めるためには、KaiCのリン酸化という旗印の下にKaiAやKaiBを招集・解散させて振動反応を力強く安定に保つことが重要であることを示します。
<今後の展開>
本研究グループは藍藻の時計たんぱく質が離合集散する様子を実時間計測し、Kaiたんぱく質という3つの歯車が何時どのように噛み合わさって時計として機能するかを解明しました。今後は、ペースメーカーの発するタイミング信号、即ちKaiAやKaiBを呼び寄せるためのKaiCの構造変化を溶液中で明らかにする必要があります。タイミング信号となる構造変化を読み解くことができれば、「KaiCがペースメーカーとしての機能を発現する機構」、「24時間を規定する構造生物学的からくり」といった重要な情報が得られると期待されます。また、生物時計の動作機構に関する理解をより深めることで、生体リズムの不調に由来する睡眠障害の治療にも貢献できる可能性があります。
<付記>
本研究成果は、野原淳志(名古屋大学大学院理学研究科 大学院生)、伊藤和輝(理研放射光科学総合研究センター 高田構造科学研究室 業務協力員)、前田雄一郎(名古屋大学大学院理学研究科 教授)らとの共同研究で得られました。
<研究領域等>
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
研究領域:「生命現象と計測分析」
(研究総括:森島績 立命館大学理工学部 客員教授)
研究課題名:「時間と共に離合集散を繰り返す分子機械のX線小角散乱・動的構造解析」
研 究 者:秋山修志(JSTさきがけ研究者)
研究実施場所:理化学研究所 放射光科学総合研究センター 宮野構造生物物理研究室
研究期間:平成17年度~平成20年度
JSTはこの領域で、生命現象の解明のために必要な新たな原理や手法に基づく計測・分析の技術に関して革新技術の芽の創出を目指す研究を進めています。上記研究課題では、生物時計の研究を通じて、多数のたんぱく質分子から成る分子機械の離合集散を可視化する技術としてX線小角散乱の研究を進めています。
<参考資料>
| (1) 最初に、3種のKaiたんぱく質KaiA、KaiB、KaiCをATPと混合します。 (2) 一定時間ごとに試料を抽出します。 (3) 抽出した一部を用い、リン酸化を受けたKaiCの割合を定量します。 (4) 残りの試料でX線小角散乱測定を行います。試料を透過したX線をビームストッパーで遮断し、その近傍に生じる微弱な散乱X線をX線検出器に記録します。 (5) 記録された画像より散乱X線の強度・角度分布(散乱曲線)を読み取り、それに合致するような複合体の部品配置を調べます。 |
| 左軸(○)には、前方に散乱されたX線の強度(原点散乱強度)から見積もった試料の重量平均分子量を、右軸(□)には、同時刻に定量したリン酸化を受けたKaiCの割合(リン酸化状態)がプロットされています。実線は周期関数による近似曲線を表します。重量平均分子量とリン酸化状態の両方が24時間の周期で振動していますが、リン酸化状態のほうが重量平均分子量よりも1/4周期進んでいることを示しています。 |
| (a) KaiAC複合体の分子形状。KaiAはオレンジ色、KaiCは青色で表示されています。 (b) KaiAC複合体の分子形状に合致するようKaiA(赤色)とKaiC(青色)の結晶構造を組み合わせたモデル。 (c) KaiBC複合体の分子形状。KaiBは紫色、KaiCは緑色で表示されています。 (d) KaiBC複合体の分子形状に合致するようKaiB(紫色)とKaiC(緑色)の結晶構造を組み合わせたモデル。 KaiAおよびKaiBは、KaiCのC2ドメイン~尾部と相互作用を形成しています。 |
| KaiAはオレンジ色のハート、KaiBは青色のひし形、KaiCは緑色の樽、リン酸は“Pi”として模式的に表示されています。 (1) KaiAを呼び寄せるため、KaiCはC2ドメインを構造変化させます。 (2) KaiAがKaiCに結合します。 (3) KaiCがリン酸化されます。 (4) KaiBを呼び寄せるため、KaiCは更にC2ドメインを構造変化させます。 (5) KaiBがKaiAC複合体に結合します。 (6) KaiCが脱リン酸化され、KaiAやKaiBがKaiCから解離します。 |
<用語解説>
*1 ATP
アデノシン三リン酸(Adenosine TriPhosphate)のことで、筋肉が収縮するときにエネルギー源として利用される物質です。生物体で用いられるエネルギー保存および利用に用いられるヌクレオチドであり、その生物体内の存在量や物質代謝における重要性から「生体のエネルギー通貨」と呼ばれます。アデノシンという物質に3つのリン酸基が結合した形をしていますが、ATP分解酵素の働きによって、リン酸基がはずされて分解されていきます。ひとつのリン酸基がはずれる毎に、約8kcal/molのエネルギーを放出します。
*2 大型放射光施設SPring-8
(独)理化学研究所が所有する、兵庫県播磨科学公園都市にある大型共同利用施設。SPring-8は、日本の先端科学・技術を支える高度先端科学施設として、日本国内外の大学・研究所・企業から年間一万人以上の研究者が利用しています。
*3 X線小角散乱計測
X線を物質に照射して散乱するX線のうち、散乱角が小さいものを測定することにより物質の構造情報を得る手法で、たんぱく質や核酸などの生体高分子、微粒子や液晶、合金の内部構造といった数ナノメートルレベルでの構造解析に用いられます。
|
<お問い合わせ先> (研究内容に関すること) 白木澤 佳子(しろきざわ よしこ) (報道担当) 理化学研究所 広報室 名古屋大学 広報室 (SPring-8に関すること) |
- 現在の記事
- 藍藻の「時計たんぱく質」が時を刻む機構を解明 - 時計を作る3つの歯車は時々刻々と組み合わせを変えながら回転する -(プレスリリース)