酸素貯蔵タンパク質「ミオグロビン」の酸素吸着メカニズムを解明(プレスリリース)
- 公開日
- 2009年04月08日
- BL17SU(理研 物理科学III)
平成21年4月8日
独立行政法人理化学研究所
国立大学法人東京大学
|
生体中に微量に取り込まれた金属元素が、タンパク質の特異な機能性を担う例は数多くあり、これらは金属タンパク質として古くから知られています。血液中で酸素を貯蔵・運搬する役割を担うミオグロビン、ヘモグロビンなどのヘムタンパク質が有名で、酸素濃度に応じた酸素吸蔵、放出のメカニズムが様々な手法によって研究されてきました。酸素を実際に吸蔵する場所、すなわちヘムと呼ばれる反応中心には、平面的に並んだ4個の窒素原子に囲まれた鉄原子=ヘム鉄があり(図1)、酸素と結合する際にこのヘム鉄が面外の5番目の窒素原子と連動して「動く」ことによって、酸素を可逆的にくっつけたり離したりできると説明されてきました。しかし実際は、酸素の吸着前後でヘム鉄のスピン状態が変化しており、室温でこの反応が可逆的に起こることがこれまで謎でした。そこで、ヘムタンパク質の中で酸素の結合に直接関与するといわれるヘム鉄の3d電子状態が注目されましたが、巨大なタンパク質の中に埋もれた1個の鉄の電子状態を実験によって観測することは、これまでできませんでした。 (論文) |
本研究で用いられた軟X線共鳴発光分光法では、図2に示すように、まず、エネルギーhνinのX線照射でヘム鉄の低いエネルギーの内殻状態にある電子を3d状態へ励起し、続いて、空いた内殻状態を別の3d状態にある電子が埋める際に発光されるX線のエネルギーhνoutを測定し、その差からヘム鉄の3d状態のエネルギー準位を決めるものです。その際、適切なhνinのX線を照射することにより、着目する鉄の電子だけを励起することができる(「元素選択性」とよばれる)のが、この手法の最大の利点です。この手法で観測された、吸着分子(図1のX)が異なるヘムに対する電子状態を比較した結果、分子の種類によってヘム鉄の価数、スピン状態が異なるにもかかわらず、ヘム鉄の3d電子準位はほとんど変化しておらず、これまでの常識を覆す事実がわかりました。これは、スピン転移の起こり易い場にヘム鉄が置かれていること、またヘム鉄の3d電子状態が広がっていて、価数の変化は鉄の部分ではなく、鉄を取り巻く5個の窒素原子が担っているためであると考えられます。ミオグロビンにおけるヘム鉄のこの特徴は、酸素吸着に伴うヘム鉄の電子状態変化が極めて小さいことを示しており、可逆的な吸脱着反応を可能にする電子的なメカニズムと考えられます。また、この特徴は半導体中に埋め込まれた遷移金属不純物の3d電子状態とよく似ており、タンパク質といえども、生体中の金属中心の性質を議論する上で、固体物理で長年培ってきた研究手法が適用できる可能性を示唆しています。
本研究は、タンパク質溶液における金属の電子状態を明らかにする実験手法を確立したものとして、多くの研究者の注目を集めています。今後、様々なタンパク質の金属中心に対して解析が行われることにより、ポストゲノムと呼ばれたタンパク質の構造解析プロジェクトの先に、電子状態解析という新たな視点を加え、タンパク質の機能性の理解がさらに進むことが期待されます。
《参考資料》
|
(問い合わせ先) (報道担当) (SPring-8に関すること) |
- 現在の記事
- 酸素貯蔵タンパク質「ミオグロビン」の酸素吸着メカニズムを解明(プレスリリース)
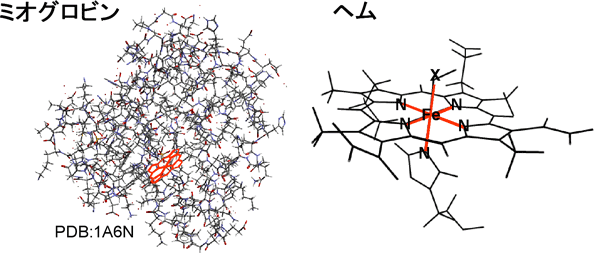 図1. ミオグロビンの分子構造例と内包されたヘムの拡大図。
図1. ミオグロビンの分子構造例と内包されたヘムの拡大図。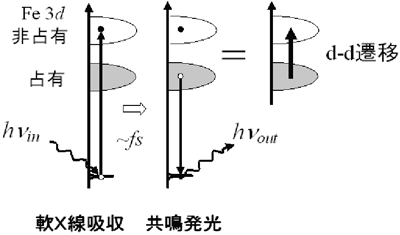 図2. 軟X線を用いた共鳴光散乱過程を利用し、タンパク質内部に埋もれた鉄の3d電子状態を抽出することができる。
図2. 軟X線を用いた共鳴光散乱過程を利用し、タンパク質内部に埋もれた鉄の3d電子状態を抽出することができる。