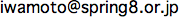高輝度X線回折により遺伝性骨格筋疾患の発症メカニズムを解明 - 少量の生検試料から診断が可能に -(プレスリリース)
- 公開日
- 2010年05月13日
- BL45XU(理研 構造生物学I)
平成22年5月13日
(財)高輝度光科学研究センター
|
高輝度光科学研究センター(白川 哲久理事長)の岩本 裕之主幹研究員、八木 直人主席研究員とスウェーデン・ウプサラ大のJulien Ochala、Lars Larsson両博士は、骨格筋の収縮弛緩をつかさどる調節タンパク・トロポミオシンを構成する284個のアミノ酸のうち、ただ一つが置き換わること(点突然変異)によっておこる筋疾患(筋力低下などの症状がある)の発症メカニズムをX線回折法により明らかにしました。この点突然変異はトロポミオシンの133番目のアミノ酸がアルギニンからトリプトファンへと変化したものです(以下「R133W」という)。 この成果は、米国の学術雑誌Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)のオンライン版(5月10日付け、日本時間の5月11日)に掲載されました。 (論文) |
《背景》
筋肉の収縮はミオシン、アクチンの2種類の収縮タンパクでできた繊維が互いに滑りあうことで起こります。骨格筋は神経刺激によって興奮したときだけ収縮し、あとは緩んで(弛緩して)いますが、このとき収縮のオンオフのスイッチ機能を担っているのはトロポミオシン、トロポニンという収縮調節タンパクです(図1)。これらの収縮調節タンパクはアクチン繊維上にあります。トロポニンはカルシウムセンサーで、トロポミオシンはアクチン繊維のラセンに沿って走る細長いタンパク分子です。弛緩しているときにはトロポミオシンがアクチンのミオシン結合部位を覆っているため、ミオシンはアクチンに結合することができません。しかし筋細胞が興奮して、細胞内に放出されたカルシウムイオンがトロポニンに結合すると、トロポミオシンが移動してアクチンのミオシン結合部位が露出するため、ミオシンはアクチンに結合し始めて収縮が開始します。
しかし実際の収縮のオンオフスイッチの働きはこれより少し複雑です。すなわちカルシウムがトロポニンに結合しただけではアクチン繊維は十分に活性化されません(図2b)。十分な活性化のためには、ミオシンがある程度アクチンに結合することが必要です(図2c,d)。この仕組みは「正のフィードバック」または「協働性」と呼ばれ、この仕組みによって小さなカルシウムイオンの濃度変化でも効果的にオンオフ制御ができるのです。
このように巧妙な制御の仕組みですから、収縮調節タンパクに突然変異が起きて機能が変化すれば様々な障害が起こることは容易に想像できます。実際、心不全を引き起こす家族性心筋症(肥大型・拡張型)は、かなりのものが収縮調節タンパクの突然変異によって生じることが明らかにされています。そして最近は、骨格筋でも同様の突然変異が種々の筋疾患の原因になることが明らかになってきました。ここで扱う骨格筋トロポミオシンの突然変異(R133W)もその1つです。
《R133Wにより引き起こされる筋疾患》
R133Wとは、骨格筋トロポミオシンを作る284個のアミノ酸のうち、133番目のアルギニンがトリプトファンに置き換わった点突然変異です。R133Wは筋力低下(断面積あたりの張力低下、張力発生速度の低下)、ネマリン・ミオパチー(筋細胞の中に棒状の沈着を生じる)、遠位関節拘縮症(手足が変形し関節が拘縮する)などの先天性疾患を引き起こします。遠位関節拘縮症のうちI型と呼ばれるものの発症率は1万人から5万人に1人と言われます。
《収縮調節タンパクの働きを調べるには》
上に述べたように、筋細胞の興奮に伴うトロポミオシン分子の移動が収縮制御にとって重要なわけですが、この移動が正常に起こっているかを観察するのに非常に有効な方法がX線回折法です。図3は生きたカエル骨格筋(縫工筋(ほうこうきん))にX線を当てて得られる回折像で、アクチンやミオシンの分子の並び方を反映した多数の反射が見えます。弛緩した筋肉を刺激して収縮させると、これらの反射のあるものは弱くなり(図3右の青い部分)、あるものは強くなります(赤い部分)。これらの変化は収縮中に筋肉中のさまざまなタンパクが構造を変えていることを反映するものですが、ここで注目するのは回折像の中心から大きく離れた場所で強く赤くなっている部分です。これがトロポミオシン分子の移動を表す反射で、ここでは便宜的にトロポミオシン反射と呼びます。トロポミオシン反射はもともと非常に弱い反射ですが、大きな縫工筋を使い十分に露光時間をかけることで精度よく測定できます。
カエルの縫工筋は筋細胞の向きも揃っており、取り出したあとも生理食塩水中で長時間生きているため扱いやすく、以前よりX線回折実験の標準試料として使われてきました。
《人間の筋肉をX線回折法で診断するには》
人間の場合は筋肉を摘出するわけにもいかず、手や足に直接X線を当てるわけにもいきませんので、生検という方法を使って組織の一部を取り出すことになります。これには「生検トレパン」と呼ばれる直径3mm程度の鋭利な金属パイプを突き刺す方法を使うのが一般的です。当然ながら一度にわずかな量の試料しか取れませんし、筋細胞は最長でも3mmの長さに切れて、刺激しても興奮しなくなります。しかし、化学処理によって細胞膜を取り除き、外から人工的にカルシウムを加えることで体内にあったときと同様に収縮させることができるのです。このように細胞膜を取り除いた筋細胞のことをスキンドファイバーといいます。測定のときは物質の拡散を速めるため、試料中の筋細胞を1本1本ばらばらにしたあとで平行に並べ、そこに細く集光した強いX線を当てることでカエル縫工筋と遜色のないX線回折像を記録することができます。
《健常者とR133W患者でのX線回折像の比較》
上に述べた方法で作成したスキンドファイバーから得られたX線回折像を健常者とR133W患者のあいだで比較したものを図4に示します。健常者(図4上側)では先ほどのカエル縫工筋と同様、収縮時(十分量のカルシウムを加えたとき)トロポミオシン反射が強く増強しているのが分かります。ところがR133W患者では、十分なカルシウムを加えてもトロポミオシン反射の増強のしかたが弱いことが分かります。ここで観察しているのは、先に述べたカルシウム結合による1段階目の活性化と、ミオシン結合による協働的活性化の両方です。それではR133Wで阻害されるのはどちらの活性化なのでしょうか?
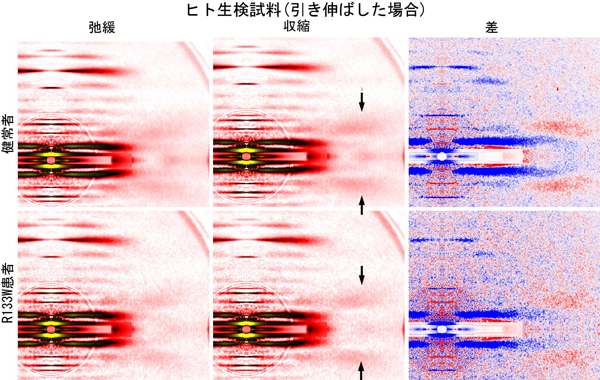
それを調べるには、ミオシン繊維とアクチン繊維が重なり合わない長さまで筋細胞を引き伸ばします(図1bの右)。こうすることでミオシン結合による協働的活性化が起こらなくなるので、カルシウム結合だけで活性化した時のトロポミオシンの動きを調べることができます。
このようにして引き伸ばしたスキンドファイバーを用い、同様にX線回折像を比較したのが図5です。引き伸ばさないとき(図4)と比べてトロポミオシン反射の増強は弱いのですが、健常者とR133W患者で比較すると後者のほうがさらに増強が弱くなっています。ですからR133W患者では、カルシウム結合による活性化の段階で、すでにトロポミオシンの動きが阻害されていることがわかります。以上から、R133W患者でみられる種々の疾患は、十分なカルシウムがあってもトロポミオシンが完全に活性化位置まで移動しないために引き起こされると考えられます。
《意義》
今回の研究結果の意義は、従来基礎研究分野で行われてきた筋肉のX線回折実験の技術がヒトの筋疾患の診断にも応用できることを示した点にあります。特に生検で得られるわずかな量の検体から、微弱なトロポミオシン反射を短時間で明瞭に記録できることを明らかにした点は重要です。これはSPring-8の輝度の高いX線に高感度・高精度の検出器を組み合わせることで初めて可能になったものと考えます。
R133Wに関しては、発症メカニズムが明らかになったことで治療薬の開発も可能になるでしょう。家族性心筋症については、心筋トロポニンに作用して収縮調節タンパク全体の働きを高める薬剤が開発されています。同様に骨格筋トロポニンに特異的に作用する薬剤を開発すれば、R133Wその他の突然変異による収縮調節タンパクの機能低下に伴う症状を軽減できることでしょう。
さらに今回説明しなかった他の多くの反射も解析することで、例えば加齢に伴う筋機能低下の分子メカニズムを調べるなど、本研究で開発された技術は筋肉に関する様々な医療分野の研究に応用できることでしょう。
《参考資料》
図1. 脊椎動物骨格筋(横紋筋)の構造
a:1個の筋節(収縮の最小単位)の構造。収縮タンパクのアクチン、ミオシンでできた繊維がある。
b:収縮は、アクチン繊維とミオシン繊維が滑りあうことで起こる。
c:アクチン繊維の拡大図。収縮調節タンパクのトロポニン、トロポミオシンとアクチン分子の位置関係を示す。
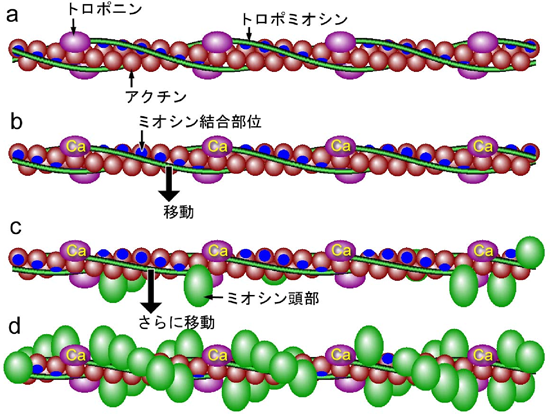
図2. 収縮調節タンパクの働き
a: カルシウムイオンのないとき(弛緩時)。トロポミオシンはアクチンのミオシン結合部位(青色)を完全に覆っているため、ミオシンはアクチンに結合することができない。
b: 筋細胞の興奮により細胞内に放出されたカルシウムイオンがトロポニンに結合すると、トロポミオシンが移動してミオシン結合部位が露出するが十分ではない。
c: bの状態に少数のミオシン頭部が結合すると、トロポミオシンはさらに移動してミオシン結合部位が完全に露出する。
d: ミオシン結合部位が完全に露出したため、多数のミオシン頭部が結合可能になり、大きな力を発生する。
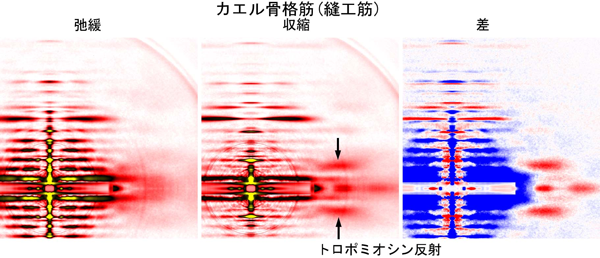
図3. カエル骨格筋(生きた縫工筋)から記録されたX線回折像。
左が弛緩時、中央が収縮時、右が両者の差を表す。収縮は筋肉の電気刺激によって引き起こした。右の図で、収縮時に強度が上がった部分を赤、下がった部分を青であらわす。トロポミオシン反射(矢印)は収縮中に強くなり、図2b,cで示したようなトロポミオシンの移動が起きているのが分かる。
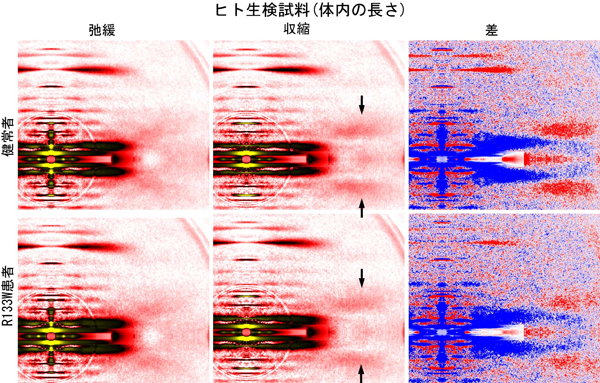
図4 健常者およびR133W患者から生検により採取した骨格筋細胞(スキンドファイバー)のX線回折像。
アクチン繊維、ミオシン繊維が十分に重なり合う状態(図1bの左)で記録。収縮はカルシウムイオンの添加により引き起こした。健常者では収縮時、トロポミオシン反射(矢印)がカエル骨格筋と同様に増強しているのが分かる。それに対しR133W患者では増強の仕方が小さい。
《用語解説》
※ 大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある、世界最高の放射光を生み出す理化学研究所の施設。その管理運営はJASRIが行っている。SPring-8の名前はSuper Photon ring-8GeVに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する、細く強力な電磁波のこと。SPring-8ではこの放射光を用いて、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究を行っている。
|
《問い合わせ先》 (SPring-8に関する事項) |
- 現在の記事
- 高輝度X線回折により遺伝性骨格筋疾患の発症メカニズムを解明 - 少量の生検試料から診断が可能に -(プレスリリース)