細胞情報伝達タンパク質を標的とした新規薬剤の作用機構を解明 -血栓の予防、抗腫瘍化作用へ期待-(プレスリリース)
- 公開日
- 2010年07月13日
- BL41XU(構造生物学I)
平成22年7月13日
国立大学法人 奈良先端科学技術大学院大学
|
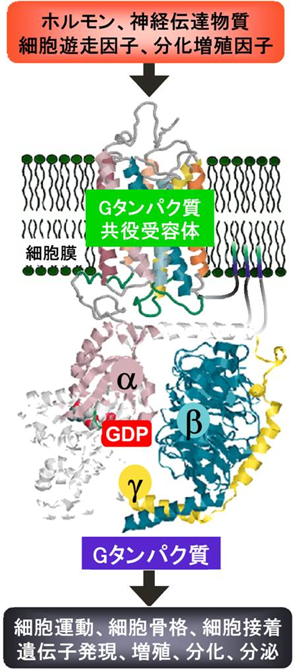
動物の体の中でホルモンや神経伝達物質が細胞に働きかけると、血管が収縮したり、神経細胞が興奮したり、血小板が凝集して血が固まったりと様々な応答が起こります。このさいに細胞外のシグナル(信号)を細胞内へ伝達する分子として細胞膜にある「Gタンパク質※1」は極めて大事な役割を果たしています。 (論文) |
《解説》
私達の身体を構成する60兆個の細胞は常に細胞同士の情報のやり取りを行って環境の変化に対応するため、筋肉を動かして移動したり、無意識に心臓の拍動を強めたり、また生体防御に役立つストレス応答ホルモンを分泌したりする。
こうした生体のメカニズムの中でGタンパク質は、身体の働きを調節する細胞の情報伝達システムで中心的な役割を担っている。光や匂いだけでなく多くのホルモンや神経伝達物質は、細胞膜の表面でアンテナの役目をする受容体に捕まえられる。受容体は細胞内部でGタンパク質と結合して、シグナルを受け渡す。シグナルを受け取ったGタンパク質は自らの立体構造を変えて情報伝達システムのスイッチを入れたり、切ったり、さらに情報を増幅したり、絶妙なバランスをとりながら数多くの生体機能を調節している。
従って、この分子の働きが狂えば、身体の安全装置が外れて病気につながることにもなる。現在使われている薬の40%は、Gタンパク質にシグナルを受け渡す受容体(Gタンパク質共役受容体)をターゲットとしている。これまで大学や製薬企業の研究者はGタンパク質共役受容体を標的とした数多くの低分子化合物を探索して、薬としての有効性を証明し、新しい薬の開発を行ってきた。しかし、最近新薬の開発速度が鈍って来ていることが問題となっている。一つの要因はGタンパク質共役受容体の立体構造の研究が思うように進まずに構造情報からの画期的な薬の開発が遅れていること、そしてもう一つの要因としてGタンパク質自身の活性を調節する低分子化合物がほとんど見つかっておらず、また調節する分子の結合部位もまったく明らかにされていなかった。
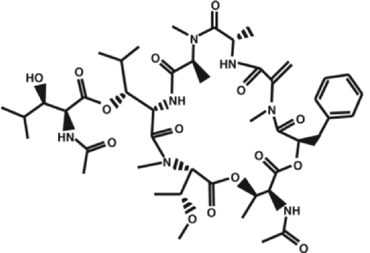
伊東教授らは分子量1000の環状化合物YM-254890(図3)に着目した。YM-254890は心筋梗塞、脳梗塞の予防治療薬の探索のため、血液を固める作用を担う血小板の凝集を阻害する物質としてアステラス製薬が多摩の土壌細菌の培養液から単離同定した物質だ。Gタンパク質を介するシグナルを阻害することは判っていたが、その作用点および作用機構は不明だった。
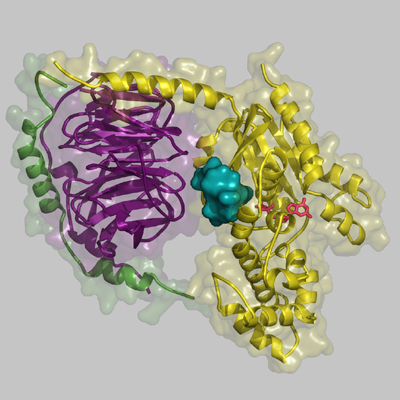
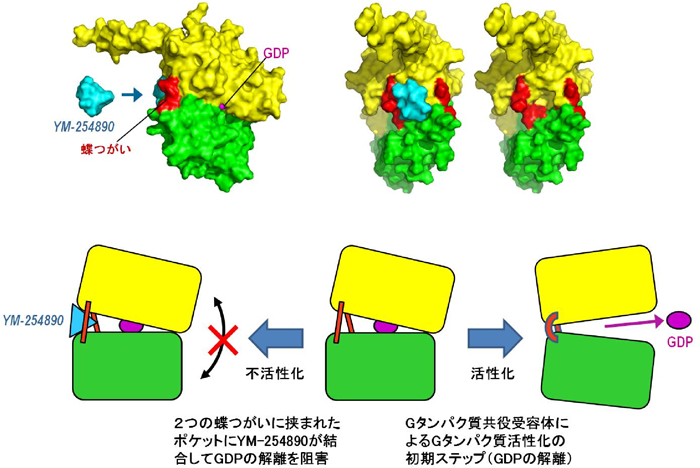
伊東教授らは、まずYM-254890が直接Gタンパク質に働きかけてシグナル伝達をブロックすることを証明した。さらにYM-254890とGタンパク質からなる複合体の結晶化およびX線結晶構造解析※3に成功した。Gタンパク質は受容体からのシグナルを受け取るとGDP(グアノシン二リン酸)が結合している不活性型のタンパク質からGDPを放出する。その際、GDPが離れるためにタンパク質が開いた構造になると考えられるが、タンパク質が開く時に蝶つがいのように働く部位からなるポケットにYM-254890は刺さっていた。
すなわちGタンパク質の立体構造を不活性化状態に固定化してしまうことでスイッチがオンになることを防いでいることを見出した(図4)。ヒトのGタンパク質は20種類程度に分類されるが、YM-254890は細胞内のカルシウム濃度を上昇させるシグナルを伝達する3種類のGタンパク質(Gq, G11, G14)にのみ働くことも判った。YM-254890が突き刺さるポケットは全てのGタンパク質に存在しているが、そのポケットの形状が微妙に異なるためYM-254890だけを入れるという選択性が現れる。このポケットの形状の違いから別のGタンパク質に選択性を持った新たな低分子化合物の設計も可能だ。それぞれのGタンパク質が異なるシグナル伝達システムを動かして様々な細胞機能を調節していることから、創薬や研究ツールの開発へのランドマークになる成果と言える。
眼のブドウ膜メラノーマや脳の下垂体腫瘍などでGタンパク質の変異が見出されている。これはGタンパク質が細胞外の刺激がなくても常にオンになってしまうことで起こる。YM-254890はこのような活性型変異体に対しても抑制作用を示すことから抗腫瘍剤の開発にも発展する可能性も期待される。
《参考資料》
《用語解説》
※1 Gタンパク質
GTP結合タンパク質の略。Gタンパク質はα、β、γの3つのタンパク質からなるが、αタンパク質にグアノシン二リン酸(GDP)あるいはグアノシン三リン酸(GTP)が結合する。結合しているGDPをGTPに置き換えることで活性型となり細胞内へシグナルを伝える。また、GTPを分解してGDPに変える酵素の働きも持っている。コレラ毒素、百日咳毒素はADPリボシル基という化学構造体をそれぞれ異なるGタンパク質に付加することでGタンパク質の働きを邪魔して疾患の原因を生じる。
※2 Gタンパク質共役受容体
光、匂いのみならず多くのホルモン、神経伝達物質を細胞膜表面で捕獲し、それら細胞外の刺激を細胞内のGタンパク質へ伝える役目を果たす。細胞膜を7回貫通する共通構造を持ち、ヒトにおいて1,000種類近く存在する。G protein-coupled receptorの略でGPCRと呼ばれる。現在、使われている薬の40-50%がGPCRをターゲットとしており、胃潰瘍の治療に劇的な効果を示す抗ヒスタミン薬、血圧、不整脈、狭心症の治療薬、緑内障治療薬、抗パーキンソン病薬など数多くの薬がGPCRに結合して治癒効果を発揮する。
※3 X線結晶構造解析
結晶にX線を照射した際におこる「回折」という現象を利用して、結晶中の原子の3次元での配置を特定し分子の立体構造を決定する方法。小さい化合物のみならず大きくて複雑なタンパク質やタンパク質とタンパク質複合体も結晶化することが出来れば、この方法を用いて原子レベルで立体構造を決定できる。強力なX線を必要とするので兵庫県播磨にある大型放射光施設SPring-8の構造生物学 I ビームラインBL41XUの放射光X線が本研究においても威力を発揮した。
《問い合わせ先》 東京大学大学院 医学系研究科 (本プレスリリースについて) (SPring-8に関すること) |
- 現在の記事
- 細胞情報伝達タンパク質を標的とした新規薬剤の作用機構を解明 -血栓の予防、抗腫瘍化作用へ期待-(プレスリリース)