薬物運搬用ナノ粒子内の構造解析に世界で初めて成功(プレスリリース)
- 公開日
- 2013年01月29日
- BL40B2(構造生物学II)
2013年1月29日
科学技術振興機構(JST)
北九州市立大学
東京大学 大学院新領域創成科学研究科
東京慈恵会医科大学 ME研究室
高輝度光科学研究センター(JASRI)
ポイント
● 高分子ミセルは次世代DDSとして期待されているが、内部の詳細な構造は未知であった。
● 新しい手法の小角X線異常散乱法をDDS粒子に初めて適用して、内部の精密な構造を解明。
● 高性能なDDS開発の基本指針を与え、遺伝子治療や抗がん剤の応用に期待。
|
JST 課題達成型基礎研究の一環として、北九州市立大学の櫻井 和朗 教授らは、次世代の薬物運搬方法(ドラッグデリバリーシステム:DDS)として期待されている数100本のひも状高分子が凝集した高分子ミセル粒子注1)の内部構造を、大型放射光施設SPring-8注2)の安定したX線計測システムと、小角X線異常散乱注3)という技法を用いて精密に解析し、粒子内部に薬剤がどのように保持されているかを世界で初めて明らかにしました。 (論文) |
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ナノ界面技術の基盤構築」
(研究総括:新海 征治 崇城大学 教授/九州大学 工学部 ナノサイエンス学科 名誉教授)
研究課題名:「DDS 粒子のナノ界面と鳥インフルエンザワクチン等への応用」
研究代表者:櫻井 和朗(北九州市立大学 国際環境工学部 教授)
研究期間:平成19年10月~平成25年3月
JSTはこの領域で、異種材料・異種物質状態間の接合界面を扱う研究分野の融合によってナノ界面機能に関する横断的な知識を獲得するとともに、これを基盤として界面ナノ構造を自在に制御し、飛躍的な高機能化を可能にする革新的なナノ界面技術を創出することを目的としています。上記研究課題では、次世代のDDSナノ粒子に関して、粒子の内部構造、粒子内の疎水/親水界面における薬物の挙動と形態、生体膜との融合挙動を、放射光を用いて精密に解明し、この結果を利用して、遺伝子デリバリーやたんぱく質製剤の分野に新しいDDS 技術を提供することを目標としています。
研究の背景と経緯
製薬メーカーでは、効果的な薬効を目指してさまざまな新規化合物の探索がなされています。しかし、副作用の強さから、たとえ非常に高い効用が見込まれていても実用化に結びつかない例が数多く存在します。普通、薬剤は、体内に投与すると血流に乗り全身へと拡散します。このため、患部へ届く薬剤の量は投与量の1,000~10,000分の1程度に激減します。また、患部以外の部分に届けられた薬剤が正常な組織を破壊し、重大な副作用を引き起こすことがあります。特に、細胞の増殖機能を強力に抑える抗がん剤ではこの副作用の問題が深刻です。これらに対する解決策の1つとして、ドラッグデリバリーシステム(DDS)があります。DDSとは、薬剤をナノサイズのキャリアに封入し、患部で選択的に薬剤を放出させる仕組みです。特に、がん細胞はナノサイズの粒子を取り込む性質があるため、この効果を利用して、ナノサイズの粒子に抗がん剤を閉じ込めたDDS粒子を使ってがんに選択的に薬剤を送達する仕組みが提案されています。
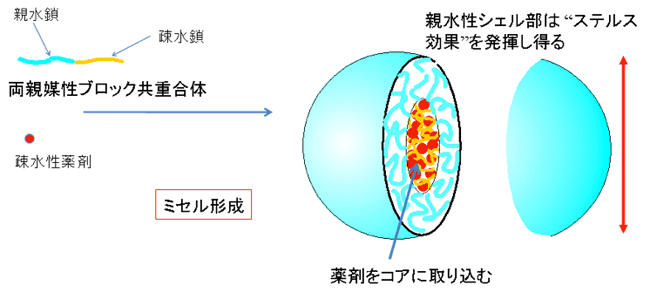
日本はDDSナノ粒子の研究では世界の先端を走っています。その中で、CRESTのメンバーである横山准教授らが研究している高分子ミセルは、人への臨床試験のフェーズIII(臨床試験の最終段階)が進められています。高分子ミセルにおいて薬剤を取り込んだり(図1)、放出したりするメカニズムは、直接DDSの働きに結びついており、このメカニズムの解明はDDSキャリアの開発、改良において非常に強力な手がかりとなります。しかし、高分子ミセルはナノサイズであるため、これまで電子顕微鏡などを用いた直接観察は不可能でした。
SPring-8の高強度で安定したX線と新しい測定法である小角X線異常散乱
X線は物質透過性の光であるため、対象を非破壊で、その内部の情報まで明らかにできます。実際にDDSキャリアの構造の決定にX線は広く利用されています。日本には世界に誇る第3世代放射光施設SPring-8があり、生命現象の根幹であるたんぱく質の構造解析などで、薬剤開発に大きな貢献をしてきました。今回、ここで得られる高強度のX線を利用することでキャリアの詳細を鮮明にすることを目指しました。SPring-8をはじめとする、第3世代の放射光施設では、安定で極めて強力なX線源を用いた先進的な構造解析に関する技術開発が進んでいます。本研究で用いた小角X線異常散乱(ASAXS)もその1つです。CRESTの雨宮教授と篠原助教のグループではこのASAXSをたんぱく質やコロイド、ミセルなどのソフトマテリアルに適用できるような研究開発を長年行ってきました。ソフトマテリアルにおけるASAXSの応用は、世界でも始まったばかりであり、日本ではほとんど行われていない状況です。安定性の高いX線ビームを得るために、CRESTのメンバーである八木副部門長のグループはX線分光器とX線検出器の安定化を行いました。特に本研究で使用したイメージングプレートX線検出器は、読み出し時の不安定性が従来から指摘されており、読み出し用レーザーの安定性を向上するなどして、常に良質のデータが記録できるよう改良を行いました。
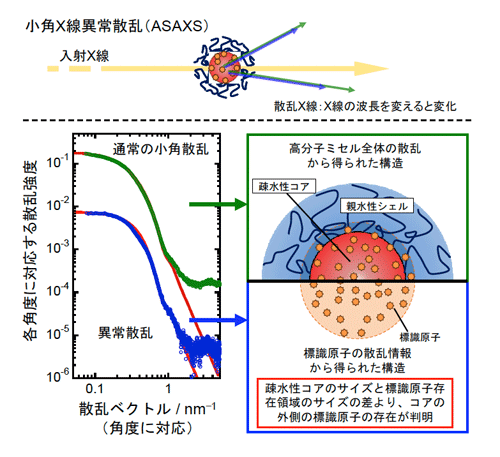
従来の小角X線散乱(SAXS)測定技術では、測定試料中の全ての情報を反映してしまうために複雑な系中の微細な違いを明らかにすることは困難です。これに対しASAXSは、特定の原子のX線吸収を利用することで、SAXSから得られる全情報から特定の原子に関する情報のみを取り出し、その原子のみの集合の形状、分布の詳細を明らかにすることが可能です。また、X線は物質透過性の光であるため、対象を非破壊でその内部の情報まで明らかにすることが可能です。ASAXSを利用し、薬剤に標識となる原子を修飾することで、キャリアの情報とは分離して薬剤の様子のみを知ることができます。
研究の内容
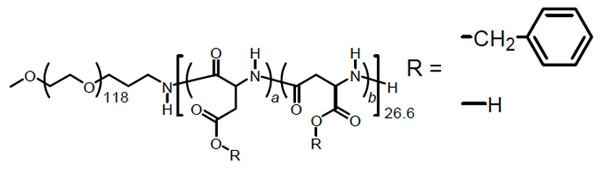
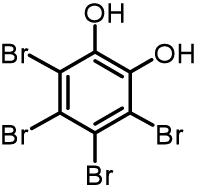
今回、ASAXSで測定した試料について説明します。高分子ミセルのキャリアは臨床試験が進められているものと成分の構造が極めて近いものです(図2)。成分は親水性であるポリエチレングリコールと疎水性に加工されたペプチドからなるひも状のポリマーであり、これが、疎水部をコア(内核)、親水部をシェル(外殻)として、水中で凝集して半径15nm程度のミセル構造を形成します。一方、薬剤のモデルとして使用した化合物を図3に示しました。ASAXS測定には、試料中にX線を吸収する原子の存在が必要となりますので、X線を吸収する原子を持たない薬剤の代わりに臭素修飾したモデル化合物を用いました。これ自体には薬理効果はありませんが、物理的性質が他の抗がん剤と近いためモデルとして使用したものです。臭素を多く付加させた理由は、臭素がASAXSのプローブとして扱いやすいためです。
ASAXS測定には極めて高いX線の純度が求められますが、SPring-8で得られる世界最高の安定かつ強力なX線源を用いることで高精度の実験結果を得ることができました。ASAXSの測定をミセル系に適用するために、図4に示す特殊な真空セルを櫻井グループで設計しました。従来は試料を空気中において測定していましたが、ノイズを低減するために、溶液を耐圧容器に封入し、真空チャンバー内に入れて測定することにしました。
これまで、疎水性の化合物は同じく疎水性のコアに取り込まれると考えられてきました。今回、ASAXSを用いてモデル化合物の分布状態を調べた結果、化合物はコアのみではなく、その外側のコアとシェルの界面にはみ出して分布していることが明らかになりました(図5)。はみ出している量は全体の5%程度であり、これらはコアとシェルの界面に作られたポリエチレングリコールの密集層の根元に1nm程度の層を作ってはみ出していることが分かりました。
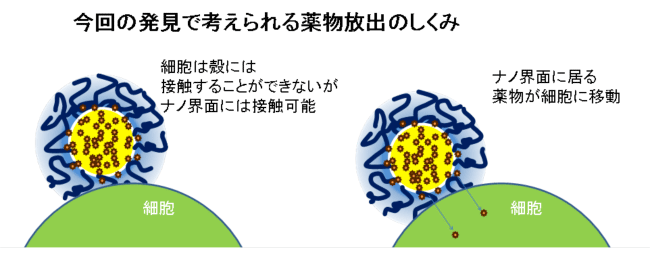
このはみ出した部分は直接周囲の水とも接しており、DDSにおける薬剤の放出挙動にも大きく関わるものと考えられます。通常コア中に取り込まれた薬剤と標的細胞が直接接することは不可能です。しかし、水と接しているこのはみ出した部分であれば標的細胞との直接の接触、ひいては高効率な送達が可能であると考えられます(図6)。このスケールでの観察は、他の電子顕微鏡などでは分解能の面から不可能でした。また、透過性のX線を用いることで、DDSキャリアが実際に作用する水中でのそのままの形態を非破壊で観察することに成功したことにもなります。
今後の展開
これまでDDSにおける薬剤の放出の詳細なメカニズムは未解明のまま、その結果の大小だけが重要視されてきました。今回の系では、これまで考えられてきた高分子ミセルが細胞内でほどけて薬剤が放り出されるものでなく、ナノ界面にある薬剤がナノ界面と細胞との接触時に直接受け渡しをするというメカニズムが示唆されました。このような薬物の放出の具体的なメカニズムが分かると、効果的なDDSの効率の良い設計が可能となります。また、薬物放出の精密な人為的制御が可能になれば、病状や個人に合わせた医薬を提供するテーラーメイド医薬の実現が期待できます。例えばがんの場合は、今まで副作用が強くて使用できなかった抗がん剤をがん細胞だけに送り、そこで精密に制御された放出が行えれば、副作用を抑えながらがん細胞だけを死滅させる治療につながります。
また、ナノオーダーの生体材料の構造がX線により精密に測定、可視化できたことは、未解明な部分の多い生体材料の微細構造解析に大きく貢献するものと期待されます。
《参考図》
親水性と疎水性からなるブロック共重合体の自己会合により形成され、内核-外殻構造を持つナノ粒子。疎水性の内核(コア)には疎水性の分子を取り込むことができ、水に溶けにくい薬剤を取り込むDDSキャリアとしての応用が期待されている。また、親水性の外殻(シェル)は体内の免疫作用による排除を受けにくいステルス効果を発揮し得る。
モデルとした高分子ミセルの成分(アスパラギン酸のベンジルエステルとポリエチレングリコールのブロック共重合体)。臨床が進んでいるキャリアに用いられているものと極めて近い。
薬剤のモデル(プローブ分子)として使用したTBC(tetrabromocatechol)。
従来は試料を空気中において測定していたが、今回は、溶液を耐圧容器(上)に封入して、真空チャンバー内に入れて測定した。これにより、従来の空気中で測定する際に必要であった窓材を省くことができ、ノイズを大幅に低減することができた。
粒子に入射したX線はさまざまな角度に散乱する。この散乱X線の角度と角度に対応する強度の関係から粒子の構造が明らかになる。また特定のX線波長を吸収する標識原子が存在すると散乱X線の強度が変化し、この変化が標識原子の状態を反映している。ミセル全体からの散乱情報と標識原子のみの散乱情報から右下図のような構造が明らかになった。疎水性コアの外側、親水性シェルの界面部に、はみ出した化合物の標識原子が見える。
これまで疎水性の薬剤は高分子ミセルの内核に封入されていると考えられてきた。通常外殻部と細胞の接触は可能だが、内核と細胞が接触することは考えにくく、内核中の薬剤がどのように細胞に送達されるのか未解明であった。今回明らかとなった薬剤が外殻のナノ界面にはみ出して存在する構造では、ナノ界面と細胞が接触した際に薬剤が容易に細胞に取り込まれると考えられる。
《用語解説》
注1) 高分子ミセル
親水性と疎水性からなる、ブロック共重合体の自己会合により形成され、内核-外殻構造を持つナノ粒子。抗がん剤であるアドリアマイシン封入高分子ミセルの開発例などがあるが、錠剤、顆粒剤、微粒子製剤の膨大な薬剤学的知識・ノウハウと比較にならない程、高分子ミセル製剤についてはその蓄積が少ない。その意味で、今後、本研究のような、製剤学的な研究が加えられることで、高分子ミセルの実用化が大幅に進むと考えられる。
注2) 大型放射光施設SPring-8
SPring-8は、世界最高性能の放射光(赤外線や紫外線、X線などを含んだ光)を利用することができる大型の実験施設であり、国内外の研究者に広く開かれた共同利用施設として、物質科学・地球科学・生命科学・環境科学・産業利用などの分野で優れた研究成果をあげている。
注3) 小角X線異常散乱(ASAXS:Anomalous small angle X-ray scattering)
ナノ構造の情報を得ることのできる小角X線散乱法(SAXS)は、ナノテクノロジーの強力な分析方法の1つとして広く使われている。小角X線散乱法では入射するX線の波長は一定であるが、小角X線異常散乱では異なる波長のX線を用いることで、特定の元素についての情報を得る。
注4) キャリア
DDSにおいて薬剤を取り込み、体内で標的部位に送達するために用いられる素材である。送達する薬剤、対象となる標的部位、求める薬効時間によってさまざまなキャリアが検討されており、その設計次第で任意の性能を持たせることができ、幅広い応用が可能である。高分子ミセルはキャリアの素材の一種である。
|
《問い合わせ先》 東京慈恵会医科大学 (JSTの事業に関すること) (SPring-8に関すること) |
- 現在の記事
- 薬物運搬用ナノ粒子内の構造解析に世界で初めて成功(プレスリリース)