ウイルス侵入の鍵となる硫酸化の仕組みを解明 -新たな医薬品の開発に期待-(プレスリリース)
- 公開日
- 2013年03月13日
- BL38B1(構造生物学III)
2013年3月13日
九州大学
宮崎大学
|
九州大学大学院農学研究院の角田佳充准教授は、宮崎大学農学部の水光正仁教授、榊原陽一教授らとの共同研究で、ヒトタンパク質チロシン硫酸転移酵素の立体構造を、ターゲットタンパク質との複合体の形で決定し、その作用メカニズムを世界で初めて解明しました。この酵素は、種々のタンパク質に目印(硫酸基)をつける働きをします。タンパク質につけられた硫酸基は、様々な生体防御機構に関係する一方で、ウイルスがヒト細胞に侵入する際にも使われます。この硫酸基をつけるメカニズムが解明されたことで、抗ウイルス薬を含めた新しい医薬品の開発が期待されます。 (論文) |
背 景
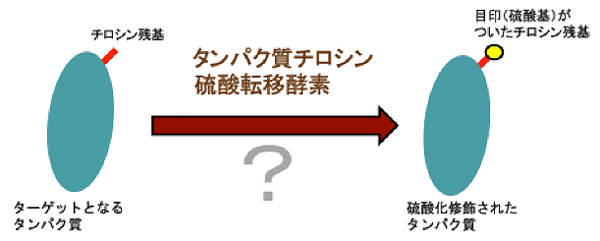
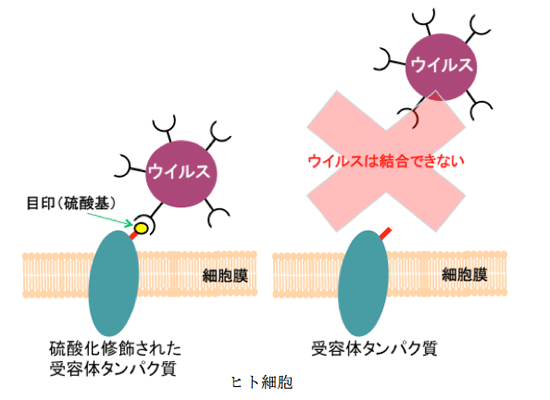
タンパク質は、細胞内でつくられた後、様々な化学的修飾を受けることで、その働きが制御されます。この一例として、タンパク質に含まれるチロシン残基(※1)に硫酸基がつけられる修飾(硫酸化修飾)を受けると、そのタンパク質の働きが大きく変わることが知られています(図1)。この硫酸化修飾は、ヒトにおける生体防御機構において、重要な役割をしています。例えば、抗体の異物認識、白血球の炎症部位への移動、補体因子の活性化などです。その一方で、ヒト細胞表面に存在する受容体タンパク質につけられた硫酸基は、エイズや手足口病などの原因ウイルスがヒト細胞へ感染する際の目印として使われます (図2)。これらの硫酸基をつける反応(硫酸化修飾)を行っているのが、タンパク質チロシン硫酸転移酵素です。
これまでに、この酵素が働くメカニズムはほとんど知られていませんでした。特に、この酵素が硫酸基をつけるタンパク質とつけないタンパク質をどのようにして選別しているのかが、大きな謎でした。
内 容
タンパク質チロシン硫酸転移酵素が、ターゲットとなるタンパク質を硫酸化修飾するメカニズムを明らかにするために、この酵素とターゲットタンパク質が結合している状態の立体構造を、X線結晶構造解析(※2)により原子レベルで決定しました。
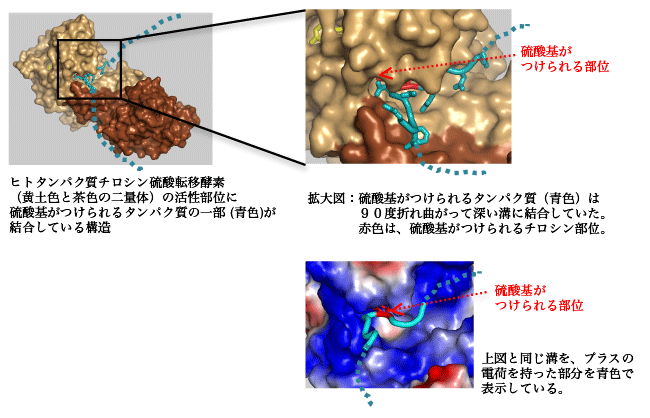
その結果、この酵素は二量体(※3)を形成し、その二量体の間につくられる奥深い溝の部分でターゲットとなるタンパク質のチロシン残基部分を結合して、その部分で特異的に硫酸基をつけていることがわかりました。また、硫酸化修飾を受ける部分は、特徴的なL字型に90度折れ曲がっていました。この構造が決定されたことにより、これまで謎であったターゲットとなるタンパク質の選別方法が明らかになりました。
その選別方法とは、「ターゲットとなるタンパク質の柔軟性の違い」と、「電荷による相互作用」の2つによるものでした。柔らかい構造をしたターゲットタンパク質は、タンパク質チロシン硫酸転移酵素の深い溝の奥に入り込み、さらに90度折れ曲がることで活性部位の適切な位置に結合して、硫酸化修飾をうけることができます。しかし、硬い構造をしたタンパク質は、この溝に入ることができず、硫酸化修飾をうけることができません。また、タンパク質チロシン硫酸転移酵素が持つ深い溝表面には、プラスの電荷が多数準備されていて、ターゲットとなるタンパク質のマイナスの電荷を持った部分を特異的に認識します。
このように、タンパク質チロシン硫酸転移酵素は、様々なタンパク質の柔軟性の違いと電荷による相互作用の両方を用いて、硫酸基をつけるターゲットタンパク質を選別していることが明らかになりました。
今後の展開
タンパク質チロシン硫酸転移酵素の立体構造が明らかになり、そのターゲットとなるタンパク質の認識方法がわかったことで、この酵素に対する阻害剤の開発が可能になりました。硫酸基がつくことによるタンパク質の機能変化は、様々な生命現象に関わっています。したがって、特異的な阻害剤が開発できれば、ウイルス感染に対する薬としての利用だけでなく、生体防御反応の制御など、新しいタイプの医薬品としての応用が期待できます。
共同研究グループ
九州大学:寺本岳大氏(現在:米NIH博士研究員、研究当時:農学研究院 博士研究員)、藤川由香莉氏(研究当時:システム生命科学府 修士学生)、川口喜郎氏(現在:システム生命科学府 博士3年)、副島正行氏(研究当時:システム生命科学府 修士学生)、安逹瑠美氏(研究当時:システム生命科学府 修士学生)、中西雄一氏(研究当時:生物資源環境科学府 修士学生)、木村誠教授、角田佳充准教授
宮崎大学:水光正仁教授、黒木勝久助教、三城恵美氏(研究当時:宮崎大学大学院 博士学生)、榊原陽一教授
米国トレド大学:Liu Ming-Cheh教授
《用語解説》
※1 チロシン残基
タンパク質を構成しているアミノ酸の一つであるチロシンの側鎖。フェノール性水酸基を持つのが特徴。
※2 X線結晶構造解析
タンパク質の分子の形(立体構造)を詳細に決定する実験方法。対象となるタンパク質の単結晶を作成しX線を照射することによって、立体構造を決定することができる。今回の成果は、大型放射光施設SPring-8およびPhoton Factoryのシンクロトロン放射光を利用することで得られた。
※3 二量体
同じ分子(特に高分子)が2つ結合した状態のもの。
|
《問い合わせ先》 宮崎大学農学部応用生物科学科 宮崎大学農学部応用生物科学科
(広報に関すること)
宮崎大学 企画総務部秘書広報課
(SPring-8に関すること) |
- 現在の記事
- ウイルス侵入の鍵となる硫酸化の仕組みを解明 -新たな医薬品の開発に期待-(プレスリリース)