「世界初、タンパク質修復に新たな分子内運動を発見」 ~ドミノ倒し運動から見えた驚きの生体分子機構~(プレスリリース)
- 公開日
- 2013年05月30日
- BL40XU(高フラックス)
2013年5月30日
国立大学法人 東京大学
国立大学法人 東京農工大学
公益財団法人 高輝度光科学研究センター
発表のポイント
♦ どのような成果を出したのか
変性したタンパク質分子を修復する機能を持つシャペロニンタンパク質分子の内部運動を1分子でリアルタイムに高精度計測することに成功しました。
♦ 新規性(何が新しいのか)
シャペロニンは8量体のリング構造が二つ重なったシリンダ構造をとりますが、ATP(アデノシン三リン酸)と結合した後に、リング内の一部が構造変化し、その後リング全体で同期したドミノ倒しに似たねじれ運動を伴って開状態から閉状態へ移行することがわかりました。
♦ 社会的意義/将来の展望
分子生物学では今まで、分子は構造を持った静止体(点)として認識してきました。今回計測した分子内部運動という新しい物性を高速高精度計測することで、今後、創薬の戦略指針や分子間相互作用の考え方が全く違ったモノになる可能性があります。
|
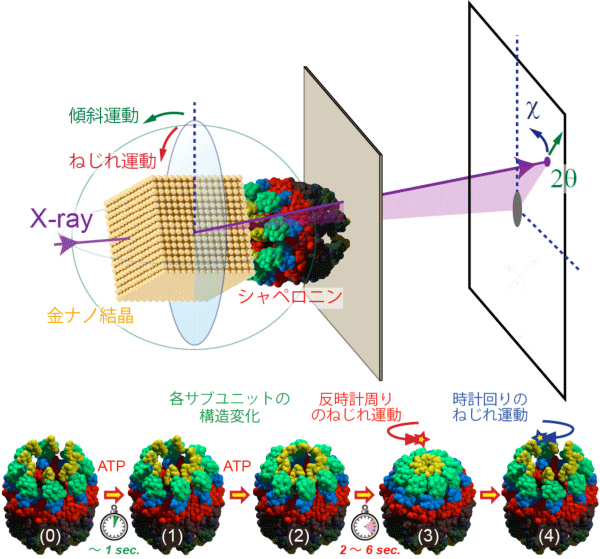
東京大学大学院新領域創成科学研究科の佐々木裕次教授を中心とする研究グループ(公益財団法人高輝度光科学研究センター(研究当時:佐々木研究室 特任助教)関口博史博士、東京農工大学 養王田正文教授ら)は、変性してしまったタンパク質分子を修復する機能を持つシャペロニンタンパク質分子の内部運動を、1分子でリアルタイムに高精度計測することに初めて成功しました。シャペロニンは8量体のリング構造が二つ重なったシリンダ構造をとりますが、ATP(アデノシン三リン酸)と結合した後にリング内の一部が構造変化し、その後、リング全体で同期した反時計方向へのドミノ倒しに似たねじれ運動を伴って、開状態から閉状態へ移行することがわかりました。これらの一連の運動は、1998年に佐々木裕次教授が考案し開発したX線1分子追跡法(DXT)(注1)を用いて、30ミリ秒の時間分解能で、ピコメートルの位置決定精度で計測されました。今までは静止画として何枚も撮影して、一連の運動を予測していましたが、実時間で見ることで、分子内部運動にどのような協同性があるかを定量的に議論できることが明確となりました。 (論文) |
発表内容
シャペロニンは構造の壊れたタンパク質と直接相互作用し、その折れたたみを促進させるタンパク質です。複数のサブユニットから構成されるリングを背中合わせに2つ重ね合わせた構造をとります。シャペロニンはATP依存的な構造変化によって機能しますが、その反応機構は、真核生物の細胞質や古細菌に存在するグループII型シャペロニンにおいては明らかでありませんでした。
東京大学大学院新領域創成科学研究科の佐々木裕次教授を中心とする研究グループ(公益財団法人高輝度光科学研究センター(研究当時:佐々木研究室 特任助教)関口博史博士、東京農工大学 養王田正文教授ら)は、佐々木教授が考案開発したX線1分子追跡 (Diffracted X-ray Tracking; DXT)を高度化し、ATP依存的なシャペロニンの分子内運動を1分子で高精度(原子の大きさの1/100であるピコメートpm精度)且つ実時間スケール(1画像30ミリ秒積算で2秒間連続測定)で観察することに成功しました。その結果、シャペロニン分子は、ATP結合後2秒以内にリング内の各サブユニットで独立した構造変化があり、その後、リング全体で同期したドミノ倒しに似たねじれ運動を伴って閉状態へ移行することがわかりました。シャペロニンリング内およびリング間の協同性を論じる上で、1分子内部の運動を明確化することは極めて重要で、生物系で一番重要と言われるアロステリック効果(注2)が、究極的な精度で定量的に初めて議論できることになり、その考案者であるジャン・ピエール・シャンジュー教授(仏国パスツール研究所)も非常に注目しています。現在すでに、上下ドメインの協同性の詳細解析や、他の巨大複合体タンパク質分子や、注目される多くのチャネル分子への適用を進めているところです。
1分子上のねじれ運動を高精度に高速に観察できる本DXT手法は、現状では、ナノ秒レベルまで高速化が進んでおり、あらゆるタンパク質分子の分子内運動を細胞上で計測できることが分かってきました。今後、本手法は学術的にも技術的にも非常に期待が膨らんでいる数少ない日本発オリジナル計測技術です。その可能性についても考案者の佐々木教授から当日ご説明します。
尚、本プレス発表は、東京大学、東京農工大学、高エネルギー加速器研究機構、高輝度光科学研究センター、及び、科学技術振興機構(JST)の共同発表で、JSTの戦略的創造研究推進事業JST/CREST研究領域「生命現象の解明と応用に資する新しい計測・分析基盤技術」(研究総括:柳田敏雄)研究課題「高精度1分子内動画計測から見える生体分子構造認識プロセス」(研究代表:佐々木裕次)で行われた研究成果です。
《用語解説》
注1 X線1分子追跡法 (Diffracted X-ray Tracking;DXT)
数10nm程度のナノ結晶をタンパク質分子に標識し、タンパク質分子の内部運動に連動したナノ結晶の動きを、ナノ結晶からのX線による回折ラウエ斑点の動きとして高速時分割追跡する手法です。佐々木裕次教授が1997年に考案し、科学技術振興事業団 (現JST)の個人研究推進事業「素課程と連携」さきがけ研究21研究員としてそのアイデアを実現し2000年に発表し、今までに多くの論文を発表してきています(Physical Review Letters, Physical Review, BBRC, Cell 等)。下図は、本研究タンパク質分子であるシャペロニンの構造変化モデル。
注2 アロステリック効果
タンパク質分子とそのリガンドである化合物が一対多の複合体を形成する際に、前の段階の複合体形成によって次以降の複合体形成反応が促進・抑制されるドミノ倒しに似た現象。アロステリーという言葉は、ギリシア語で「別の」を意味するallosと「形」を意味するstereosに由来する。アロステリック効果はジャック・モノー(1965年度ノーベル生理学医学賞受賞者)、ワイマン、ジャン・ピエール・シャンジューらによって提案された。分子の協同性という言い方もする。
|
《問い合わせ先》
(SPring-8に関すること) |
- 現在の記事
- 「世界初、タンパク質修復に新たな分子内運動を発見」 ~ドミノ倒し運動から見えた驚きの生体分子機構~(プレスリリース)