食中毒を引き起こすウェルシュ菌の毒素と受容体の複合体構造を解明 (プレスリリース)
- 公開日
- 2015年03月02日
- BL32XU(理研 ターゲットタンパク)
国立大学法人名古屋大学
研究成果のポイント
• 食中毒の原因菌の1つであるウェルシュ菌が作り出す毒素エンテロトキシン(CPE)は、我々の腸内上皮細胞シートに傷をつけて下痢を引き起こす。その毒素の一部(C-CPE)が、上皮細胞シート内でタイトジャンクション(Tight Junctions)と呼ばれるベルト状の細胞接着構造に含まれるクローディンを受容体として結合複合体を形成する機構は謎であったが、立体構造に基づいて初めて明らかにした。
• 上皮細胞間隙のバリア機能を担う分子である「クローディン」と、その間隙を広げる毒素C-CPE複合体の立体構造を、世界で初めて原子レベルで解明した。その結果、クローディン分子が細胞外部分を利用して指先で毒素を掴むような様式で、指紋認証のように特異的に認識結合していること、更に毒素の結合に伴い本来の立体構造が変化することで、ベルト状のタイトジャンクションストランド構造の崩壊を引き起こすことが明らかになった。
• 本研究の成果から、ウェルシュ菌由来の食中毒予防薬の設計や、血液脳関門(Blood-Brain Barrier)などのバリアを通過するようなドラッグデリバリー法の開発の基礎となりうる情報が得られた。
|
名古屋大学細胞生理学研究センター(CeSPI)・大学院創薬科学研究科の藤吉 好則 特任教授、大阪大学大学院生命機能研究科・医学系研究科の 月田 早智子 教授らの共同研究グループは、大型放射光施設SPring-8のBL32XUを利用して、ウェルシュ菌が産生する毒素の一部(C-CPE)と、受容体であるクローディン19が結合した複合体構造を原子分解能で解明することに成功しました。この構造解析により、クローディンが掌のような形状をした細胞外部分を利用して毒素を指先で掴むように認識し、この接触領域におけるアミノ酸配列の違いによって同じファミリーでも毒素感受性に差がでることを構造生理学的に理解することができました。更に、毒素の結合に伴うクローディン分子の構造変化によって、タイトジャンクションのベルト状構造の崩壊、細胞間隙バリアを緩める機構も明らかになりました。 (論文) |
背景
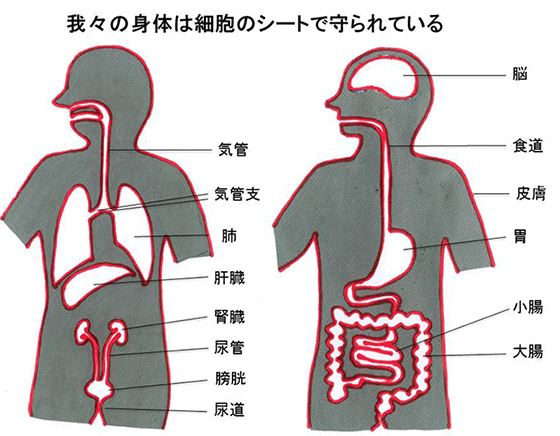
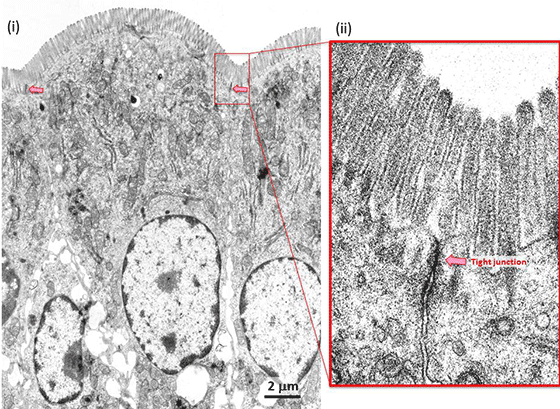
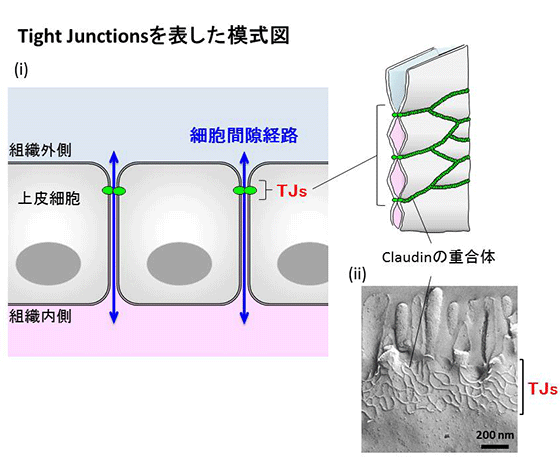
我々の身体は、上皮細胞が体表面や器官表面をシート状に覆う事により内と外を分け隔てることで内部の恒常性を保っています(図1)。上皮細胞シートにおいては、タイトジャンクションと呼ばれる細胞間接着構造がベルト状に細胞外周を取り囲むことで、隣り合う細胞同士を密着させてバリア機能を担っています(一例として、小腸のタイトジャンクションの電子顕微鏡像の図3と、模式図などを示す図4参照)。このタイトジャンクションの中心となっている分子は「クローディン」と呼ばれる膜タンパク質ですが、この分子がどのような構造をとっていて、どのようにしてベルト状の形態を形成するのかは、月田承一郎らによるクローディンの発見から15年以上を経て、昨年ようやく我々の共同グループにより、その一端を説明することができるようになりました。しかし、ウェルシュ菌の毒素がタイトジャンクションへ結合することから始まる食中毒感染やクローディンファミリー内の異なる毒素感受性、あるいは毒素が細胞間隙を広げる構造学的なメカニズムに関して、ほとんどが謎の状況でした。
研究成果
多細胞生物は、体表面および器官表面を上皮細胞と呼ばれるシート状の細胞でシールすることにより、体の内を外界の変化から守っています(図1)。例えば、小腸の単層上皮細胞や血管の内皮細胞などにより覆われて、体内に個々のコンパートメントを形成しています。上皮細胞シートがイオンや小分子に対する隔壁として機能するために、上皮細胞は上下の極性を持ち、その側面には隣接する細胞間との複数の接着装置が存在します。例えば、小腸上皮細胞では細胞の外側(小腸の管の側:アピカル側)に近い細胞部分にタイトジャンクションが形成され(図3)、ジップロックのように細胞膜間を密着させて細胞と細胞の間の“すきま”をせばめ、物質の通過を制限するバリアとして機能しているのがタイトジャンクションです(図4)。
このタイトジャンクションストランドの基本骨格を構成する膜内在性タンパク質の実体は、古瀬・月田らによって1998年に同定され、「クローディン」と名付けられました。このクローディンは現在ではヒトやマウスにおいて27種類のメンバーが確認されており、組織ごとに異なるタイプのクローディンが複数種発現することにより、器官特異的なバリア機能を発揮する事ができると考えられています。クローディン同士は、タイトジャンクションにおいて同一膜平面内で線状に重合するとともに、隣接する細胞間で接着するというユニークな機能によりタイトジャンクションストランドを形成しますが、ウェルシュ菌による毒素によって、このファミリー内のうち、どのタイプがどのような形の変化を起こし、どのようにタイトジャンクションから脱重合していくのかは、これまで構造生理学的には全く明らかになっていませんでした。
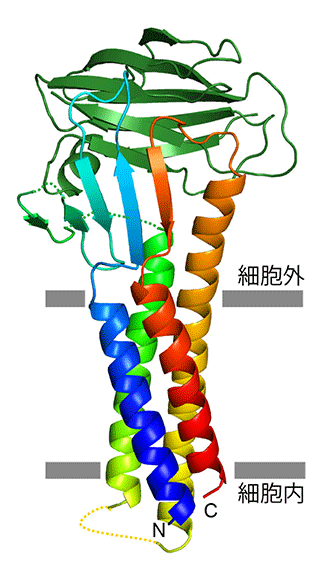
今回、名古屋大学と大阪大学の共同研究グループは、マウス由来のクローディンタンパク質の1つであるクローディン19とウェルシュ菌の毒素エンテロトキシンの一部(C-CPE)が形成する複合体を結晶化し、大型放射光施設SPring-8のBL32XUを利用して回折データを取得することにより、その結晶構造を3.7 Å分解能で決定する事に成功しました。その結果、クローディン19は、幅約3ナノメートルの大きさの分子であり、4回膜貫通型のタンパク質として、昨年Science誌上で報告したクローディン15と同じ折りたたみ構造を取っていました(図5)。毒素が結合できないクローディン15では細胞外側の2つのループ領域がひと続きのβシート構造を形成していたのに対し、毒素が結合したクローディン19では2つのβシート構造に分割されたようになっている事が明らかになりました。また、クローディン19単量体は、細胞外に掌を向けたような構造(形にちなみ「掌(パーム)」と命名)で毒素側へ向いており、特に、このβシート構造の分割により、毒素へ接触しているのはβ1, 2, 5だけに限定されるため、あたかも3本の指先だけで掴んでいるように見えます(図6)。これまで毒素感受性を決めている要因であると言われてきた、親指に見たてたβ5付近の細胞外領域は毒素にぴったりと接着しており、その形状の相補関係からも特異的な結合を形成していることがはっきりしました。一方で、毒素感受性に依存せずファミリー内で保存性の高い領域であったため、これまで結合に関与しないと思われていた他の2本指に相当するβ1, 2も毒素との結合に重要であることもわかってきました。更に、立体構造に基づいた網羅的な変異実験を行い、このような結合様式が生体内の環境に近い状態でも起こることを確認しました(図7)。
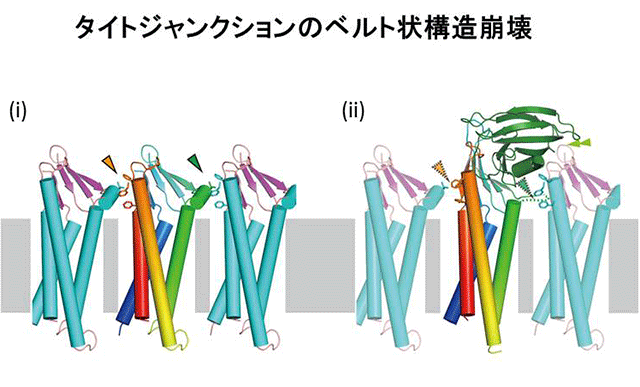
これまでに私たちはタイトジャンクションのストランドモデルをクローディン15の結晶構造を基に提示し、変異導入実験と電子顕微鏡観察により確認しています。このストランドモデルに対して毒素と結合したクローディンを重ね合わせてみますと、毒素結合型クローディンがタイトジャンクションストランドから離脱していく状況を考察することができました(図2)。特に、①ストランド形成に重要である掌モデルで示した領域の一部(ECH)がディスオーダーして見えなくなること、②親指に見立てたβ5を含むECS2領域の毒素との相互作用に伴う構造変化、③結合した毒素が隣のクローディン分子とぶつかるといったことにより、ストランド形成が阻害されるのだろうと推測しました(図2)。
今回の構造解析により、タイトジャンクションストランドの基本単位としてのクローディンの構造と毒素との複合体が初めて明らかになり、今後、より高次の重合体構造解析の基礎となると共に、多細胞生物の恒常性維持の根幹であるバリア機能についての理解を深め、新たな研究を促す結果として期待されます。特に、タイトジャンクションによるバリア機能は、血液脳関門における血管内皮細胞間隙の物理的障壁として有名であり、この機能制御による脳への薬剤浸透を可能にするようなドラッグデリバリー法の開発が期待されており、本研究はそのような創薬への貢献も期待されます。
《参考図》
この図の赤色の線で示すような細胞シートが体表面や器官表面を覆うことによって、身体や器官が守られている。なお、脳や肝臓は胃や腸などとは異なるシール構造をしている。
(i) 細胞膜上でクローディンが重合した構造。隣の分子同士で重合する際に重要な接触部位を矢頭で示す。特に、緑色矢頭の真下にある短いヘリックスは、ECHと呼ばれる重合時に重要な細胞外部分。
(ii) 毒素C-CPE(緑)が結合することで、クローディンの構造が変化し、特に短いヘリックスECH(緑色矢頭の真下にある破線)はディスオーダーし、2か所の接触部位が消失する(半透明矢頭)。更にC-CPEが隣の分子とぶつかる(二重矢頭:黄緑)ために、タイトジャンクションのベルト状構造が不安定になり、壊れていく。
赤い矢印で示す様に、小腸上皮の細胞間にはタイトジャンクションと呼ばれるバリアが形成されている。上皮細胞の外に近いところ(アピカル側)で、隣り合う細胞間を密に接着している。
クローディン分子(虹色)は、4本の膜貫通へリックスが左巻きの束を形成しており、細胞外側の2つのループにより形成される5つのβストランドでシート状のドメイン構造を形成している。C-CPE(深緑色)は、β1、β2および膜貫通へリックスTM3からβ5の3領域で結合している。
(i) 毒素結合前の構造。細胞外側の2つのループにより形成される5つのβストランドは、掌(黒色)のような構造を形成する。
(ii) 毒素結合後の構造。細胞外側の3つのβストランドを用いて毒素C-CPEと結合する。その際、掌部分とは接触することはなく、あたかも3本のβストランドを指先のようにして毒素を掴みます。
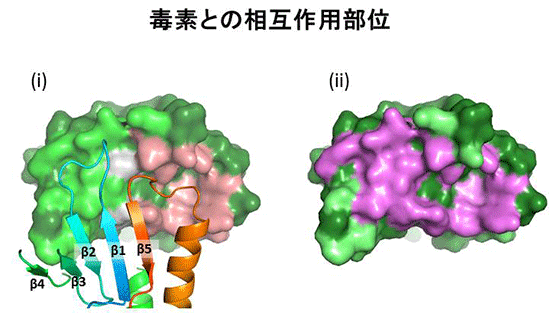
(i) 立体構造モデル。クローディン:リボンモデル(虹色)、C-CPE:表面モデル(ECS1との相互作用部位:黄緑、ECS2との相互作用部位:サーモンピンク、両方:灰色)。
(ii) クローディンの点変異体に伴うC-CPE結合能変化を相互作用する残基に対してマッピング(大幅に減少:紫色、わずかに減少:ライム)。
|
《問い合わせ先》 (SPring-8に関すること) |
- 現在の記事
- 食中毒を引き起こすウェルシュ菌の毒素と受容体の複合体構造を解明 (プレスリリース)