SACLAでタンパク質の硫黄原子を利用した結晶構造の決定に成功 -創薬ターゲットとなる多様なタンパク質の未知な立体構造の解析が可能に-(プレスリリース)
- 公開日
- 2015年11月30日
- SACLA
2015年11月30日
理化学研究所
大阪大学
高輝度光科学研究センター
|
理化学研究所放射光科学総合研究センターSACLA利用技術開拓グループの菅原道泰特別研究員、岩田想グループディレクター(京都大学大学院医学研究科 教授)、XFEL研究開発部門ビームライン研究開発グループの矢橋牧名グループディレクターと東京大学大学院理学系研究科の中根崇智研究員、大阪大学蛋白質研究所蛋白質解析先端研究センターの鈴木守准教授、高輝度光科学研究センターXFEL利用研究推進室登野健介チームリーダーらの共同研究グループ※は、X線自由電子レーザー(XFEL)施設「SACLA[1]」のX線レーザーを用いた「連続フェムト秒結晶構造解析(SFX)[2]」(1フェムト秒は1,000兆分の1秒)と呼ばれる手法により、タンパク質が持つ硫黄原子を利用した結晶構造の決定に成功しました。SACLAのX線レーザーを用いたSFXでは、これまで課題だった試料の放射線損傷[3]が起こることなく、マイクロメートル(µm)サイズかそれ以下のタンパク質微小結晶でも立体構造が決定できます。 論文情報 |
背景
原子分解能でのタンパク質の三次元立体構造はその機能を理解するうえで重要な情報源となります。その立体構造を決定するには、タンパク質結晶を用いたX線結晶構造解析が適しています。大型放射光施設「SPring-8」の放射光[9]を用いる場合、一般に約30 マイクロメートル(µm)以上のタンパク質結晶が必要です。しかしながら、30 µm以上のタンパク質結晶を得るのは困難で、特に創薬などの研究用途で重要なヒトを含む動物由来のタンパク質は、結晶化に使用できる十分な量を得るのが難しく、析出する結晶も回折実験に適した十分なサイズに成長しません。また、回折実験ではタンパク質結晶が放射線損傷を受けることも大きな問題でした。
X線自由電子レーザー(XFEL:X-ray Free-Electron Laser)は、SPring-8の放射光より10億倍も明るいため、マイクロメートル(µm)かそれ以下のサイズのタンパク質微小結晶でも構造解析ができます。現在稼働中のXFEL施設は、理研の「SACLA」と米国のSLAC国立加速器研究所の「LCLS(Linac Coherent Light Source)」があり、また欧州、アジアでXFEL施設の建設計画が進行中です。
SACLAの10フェムト秒以下という超短時間でのX線レーザーの照射により、タンパク質が壊れる前に微結晶の回折イメージを検出できます。このXFELの特性を利用した主なタンパク質の構造決定法として、連続フェムト秒結晶構造解析(SFX:Serial Femtosecond Crystallography)が注目されています。主にジェットインジェクターと呼ばれる装置から噴出した多数の微小結晶を含む液体にX線レーザーを照射し、各結晶からの回折データを連続的に収集します。SFXは常温で実験を行えるため、従来の低温条件下(100 K程度)で行う回折実験とは異なり、生理条件(生体内)に近い構造を得ることができます。
X線結晶構造解析では、ターゲットタンパク質とよく似た構造が既にある場合、分子置換法[10]と呼ばれる構造決定法が用いられます。一方、類似構造が無い場合はタンパク質に水銀、白金等の重原子を結合させ、その重原子の異常分散効果を利用することで構造決定を行う方法を用います。しかしながら、タンパク質によっては結合する重原子が見つからない場合や重原子化により結晶に損傷を与えてしまう場合もあります。そのような場合、タンパク質が持つアミノ酸のセレン、システインの硫黄原子を利用した単波長異常分散法(S-SAD法)が利用できます。S-SAD法ではタンパク質が持つ硫黄原子を利用するため、得られた結晶をそのまま使える利点がありますが、重原子と比べて非常に弱い硫黄原子からの異常分散シグナルを利用するため、SN比の良い多くの回折イメージを収集する必要があります。本研究ではSACLAのX線レーザーを用いたSFXで、S-SAD法による初のタンパク質構造決定を試みました。
研究手法と成果
共同研究グループはこれまでにSFXにおけるサンプル供給手法として「グリースマトリックス法」の開発に成功しています注1)。従来のジェットインジェクターを利用したサンプル供給では、構造を決定するために10~100 mgのタンパク質が必要でしたが、グリースマトリックス法では低速でサンプルを流すことができるため、その結果として1 mg以下のサンプル量での構造決定が可能です。本研究ではこのグリースマトリックス法を用い、測定波長1.77オングストローム(1Åは100億分の1m)で、サイズ約7~10 µmのリゾチーム結晶(図1)から、回折分解能2.1Åの回折データを収集しました。
注1)2014年11月11日プレスリリース「連続フェムト秒結晶構造解析のための結晶供給手法を開発」
リゾチーム結晶のサイズは、7~10µm。スケールバーは、50µm。
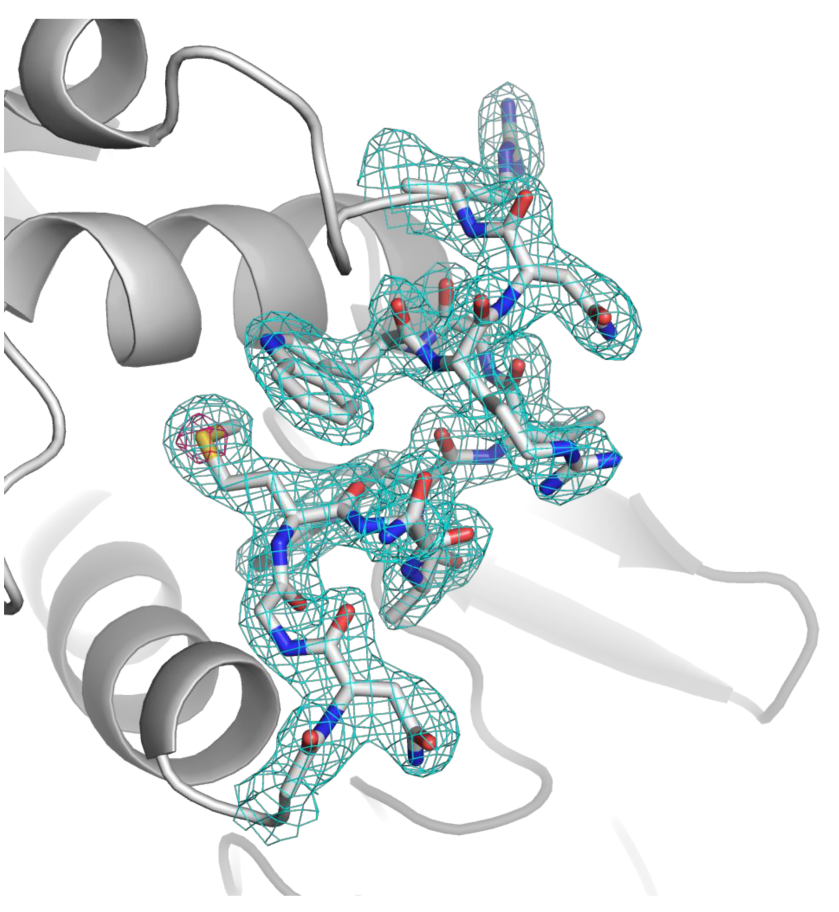
6時間程度の測定時間で構造解析に利用できる180,000枚の回折イメージを収集し、そのうち150,000枚のイメージを用いることでS-SAD法によるリゾチームの結晶構造の決定に成功しました(図2)。これにより、SACLAのX線レーザーとグリースマトリックス法を使うことで、S-SAD法による構造決定に十分な精度の回折イメージを収集できることを実証しました。
図中の青色のメッシュは電子密度、赤色のメッシュは硫黄原子から検出した異常分散シグナル、メッシュ内スティックモデルの黄色は硫黄原子、青色は窒素原子、赤色は酸素原子、および灰色は炭素原子を示す。
今後の期待
SACLAの10フェムト秒以下という超短時間でのX線レーザーの照射を用いたSFXは、30 µm以下のサイズの、また放射線損傷を著しく受ける結晶から回折データを収集することができます。最近では京都大学中津亨准教授の研究グループにより、SACLAを利用した水銀誘導体タンパク質での新規結晶構造の決定に成功しています注2)。また、重原子化が難しいタンパク質サンプルではS-SAD法を利用することで、これまで解析が困難であったタンパク質の立体構造の決定が可能になります。このようにSACLAではタンパク質に応じて様々な構造解析法を利用できることが実証され、今後、創薬ターゲットとなる膜タンパク質[11]を中心とした様々なタンパク質の構造解析への適用が期待できます。
注2) Keitaro Yamashita et al., An isomorphous replacement method for efficient de novo phasing for serial femtosecond crystallography (2015) Scientific Reports 5, 14017.
【補足説明】
[1] SACLA
理研と高輝度光科学研究センター(JASRI)が共同で建設した日本初のX線自由電子レーザー(XFEL:X-ray Free-Electron Laser)施設。加速器の中で電子の固まりを正確な制御の下で一斉に振動させ、その電子の固まりからX線レーザーを発生させるX線発生装置。2006年度から5年間の計画で建設・整備を進めた国家基幹技術の1つ。2011年3月に完成し、SPring-8 Angstrom Compact free-electron LAser の頭文字を取ってSACLAと命名された。
[2] 連続フェムト秒結晶構造解析(SFX)
多数の微結晶を含む液体などをインジェクターから噴出しながら、X線レーザーを照射し結晶構造を解析する手法。配向の異なる多数の微小結晶からの回折データを連続的に収集する。SFXは、Serial Femtosecond Crystallographyの略。
[3] 放射線損傷
X線の持つエネルギーによって、X線と相互作用した分子が壊れること。X線との相互作用で分子が壊れる場合だけでなく、分子が壊れる過程で生じる電子や、壊れた分子から生成する反応性の高い分子が観察対象の分子と化学反応する場合もある。一般的にタンパク質結晶の放射線損傷は、X線と水の相互作用をきっかけに、X線照射後ピコ秒の時間スケールで水から生成する反応性の高い分子がタンパク質と化学反応することで起きる。
[4] 異常分散効果
物質にX線が入射されると吸収が起こり、この吸収は元素固有のX線エネルギー(吸収端)で大きくなる。その際、屈折率、散乱能が急激に変化する。この共鳴効果を異常分散効果と呼ぶ。
[5] 硫黄原子を利用した単波長異常分散法(S-SAD法)
SAD法は、異常散乱原子に見られるX線散乱強度の波長依存性(異常分散効果)を利用し、一般にはその波長依存性の極大が生じる(単)波長で収集した回折データから立体構造を決定する方法。タンパク質の持つアミノ酸の硫黄原子を利用したSAD法がS-SAD法。
[6] SPring-8
兵庫県播磨科学公園都市にある世界最高の放射光を生み出す理研の大型放射光施設。その運転管理と利用者支援は高輝度光科学研究センター(JASRI)が行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来する。
[7] グリースマトリックス法
各種機械の潤滑剤として広く利用されているグリースに結晶を混ぜ込むことで、サンプルインジェクターからゆっくりとサンプルを押し出す方法。本手法によりサンプル消費量の大幅な低減を可能にした。詳細は2014年11月11日プレスリリース「連続フェムト秒結晶構造解析のための結晶供給手法を開発」を参照。
[8] リゾチーム
多糖類を加水分解する酵素の一つ。本研究で用いたニワトリ卵白リゾチームは129個のアミノ酸残基により構成しており、2個のメチオニン、および8個のシステインを含む。タンパク質のX線結晶構造解析において、リゾチームはモデルタンパク質としてよく用いられる。
[9] 放射光
相対論的な荷電粒子(電子や陽電子)が磁場で曲げられるとき、その進行方向に放射される電磁波。放射光は明るく、指向性が高く、また光の偏光特性を自由に変えられるなどの優れた特徴を持つ。
[10] 分子置換法
X線結晶構造解析において、タンパク質の立体構造を決定するには、X線回折強度データに加えて、位相情報が必要である。分子置換法はその位相を求める方法の一つ。分子置換法は、既知の類似タンパク質の立体構造とX線回折強度データを用い、分子の回転・並進関数を計算し初期位相を決定する。
[11] 膜タンパク質
生体膜を構成しているタンパク質で、全ゲノムをコードするタンパク質の3分の1を占める。生体膜の表面にあるタンパク質と内部に埋もれたタンパク質がある。生体膜の表面に付着しているものを膜表在性タンパク質、内部に埋もれているものを膜内在性タンパク質と呼ぶ。外界からの刺激に反応する受容体、イオンポンプなどの輸送体など、環境からの刺激を強く受けるタンパク質であるため、創薬の重要なターゲットとされ、高効率な構造・機能解析法の創出が待たれている。
|
<<お問合わせ先>> 理化学研究所 広報室 報道担当 大阪大学 蛋白質研究所 庶務係 (SPring-8に関すること) |
- 現在の記事
- SACLAでタンパク質の硫黄原子を利用した結晶構造の決定に成功 -創薬ターゲットとなる多様なタンパク質の未知な立体構造の解析が可能に-(プレスリリース)