細菌の分泌装置蛋白質の構造を原子レベルで解明!-生命に普遍的なATP合成酵素の起源は細菌の毛や毒針?- (プレスリリース)
- 公開日
- 2016年03月15日
- BL41XU(構造生物学I)
平成28年3月15日
国立大学法人 大阪大学
研究成果のポイント
• 細菌の「毒針」や「べん毛」の分泌装置(III型分泌装置)で働くATP加水分解酵素注1(FliI)とその調節蛋白質(FliH)の複合体構造を原子レベルで解明
• III型分泌装置のATPの複合体が、ATP合成酵素注2や細胞内で水素イオンのポンプとして働くV型ATPアーゼ注3の祖先型であることを示唆
• 細菌を殺さず病原性のみを奪うことで、副作用が少なく耐性菌のできにくい感染症薬剤開発につながることを期待
|
大阪大学大学院理学研究科の今田 勝巳教授、生命機能研究科の南野 徹准教授らは、細菌の蛋白質分泌装置(III型分泌装置)で働くATP加水分解酵素と固定子の複合体構造を原子レベルで明らかにしました。III型分泌装置は、病原因子となる蛋白質を細胞に送り込むいわば細菌の「毒針」で、感染に必須の構造体であることから世界中で研究が行われていますが、分泌のしくみはよくわかっていませんでした。本研究で解明したこの構造から、III型分泌装置が、生物に普遍的にみられるATP合成酵素やV型ATPアーゼの祖先型に相当することが示されました。 掲載論文・雑誌 |
● 研究の背景
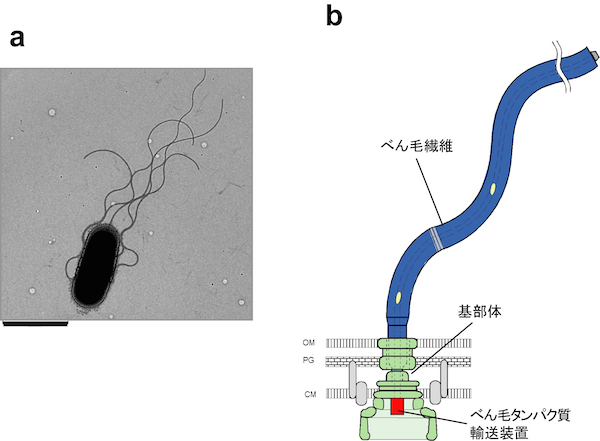
病原性細菌は、「III型分泌装置」と呼ばれる器官を使って病原因子蛋白質をヒト・動物・植物の細胞に直接送り込み、感染します。III型分泌装置はいわば細菌の「毒針」であり、感染に必須の構造体であることから世界中で研究が行われていますが、分泌のしくみはよくわかっていません。共同研究グループは、III型分泌装置の一種である「べん毛III型輸送装置」に着目し研究を進めてきました。べん毛は繊維状の運動器官で、細菌はべん毛をスクリューのように回して水中を泳ぎます(図1)。
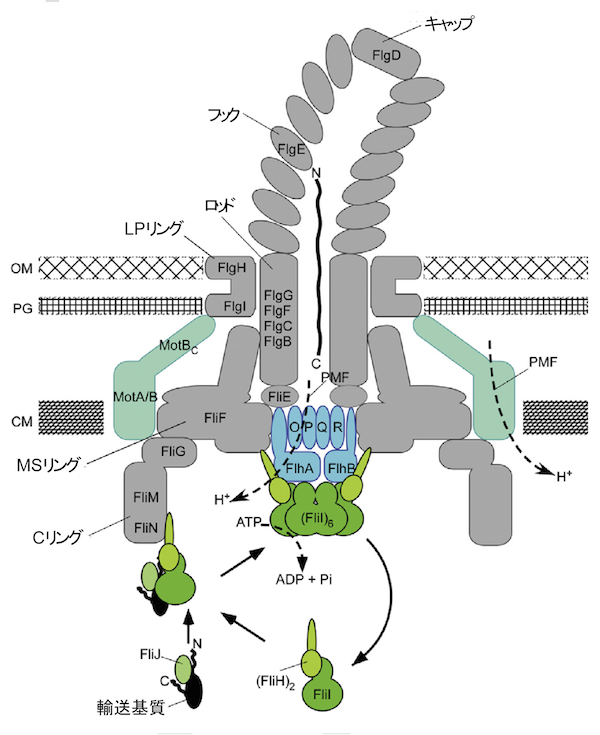
べん毛は数万個の蛋白質でできており、構成材料となる蛋白質は菌体内でつくられた後、べん毛の根元にあるべん毛III型輸送装置を通って細胞膜外へ輸送され、成長中のべん毛末端へ運ばれます。この装置は9種類の蛋白質が数十個が集まってできた超分子複合体で、細胞膜に組込まれた輸送ゲート複合体と細胞質に突き出た輸送ATPアーゼ複合体で構成されます(図2)。共同研究グループは、これまでに輸送ATPアーゼ複合体を構成する3種類の蛋白質のうち、ATP加水分解酵素FliIと複合体の中心軸となるFliJの2種類の蛋白質の構造を明らかにしました。しかし、FliIと強く結合するFliHの構造や複合体を形成したときの構造は不明でした。
● 手法と成果
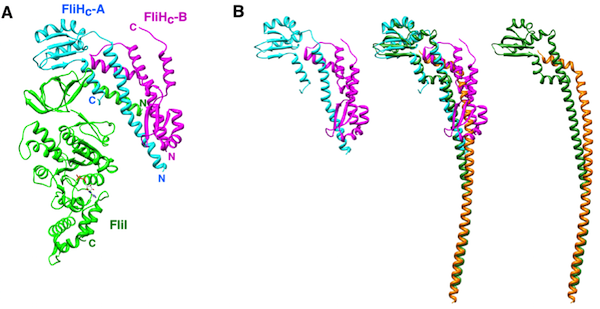
共同研究グループは、結晶化のために一部を削ったFliHとFliIの複合体の結晶を作成し、大型放射光施設SPring-8で収集したX線回折データを用いてFliH-FliI複合体の構造を原子レベルで解析しました(図3A)。その結果、2個のFliHがゴルフクラブのような構造を形成し、ゴルフクラブのヘッドに相当する部分でFliIに結合することが明らかになりました。驚いたことに、2個のFliHは同じアミノ酸配列を持つにも関わらず、互いに全く異なる立体構造をとって組み合うことで、ゴルフクラブ状の構造を形成していました(図3B)。また、この構造はV型ATPアーゼの外周固定子と呼ばれる部分とほぼ同じ構造をしていました。V型ATPアーゼは細胞内の様々な場所でpHを調節するために働くイオンポンプです。V型ATPアーゼの外周固定子は、EサブユニットとGサブユニットと呼ばれる2つの蛋白質でできていますが、2個のFliHはそれぞれのサブユニットにきれいに重なります(図3B)。また、この重ね合わせを元にEサブユニットとGサブユニットのアミノ酸配列を比較すると、両者は35%の一致を示しました。
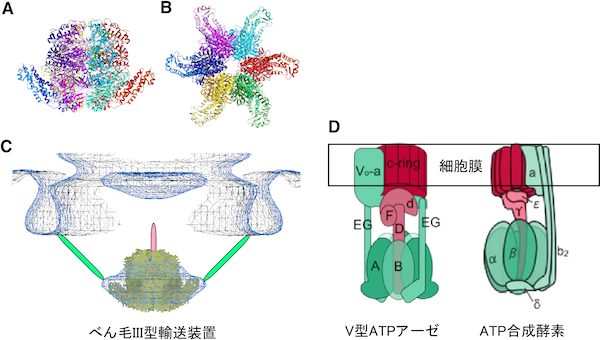
従って、V型ATPアーゼの外周固定子は、FliHのように元々同じ蛋白質2個でできていたものが異なる2つの蛋白質に分化したと考えられます。また、べん毛III型輸送装置のATPアーゼ複合体はFliI分子を6個含んでいますが、V型ATPアーゼやATP合成酵素はFliIと似た構造を持つ2種類の分子を3個ずつ(計6個)含み、より複雑で分化が進んでいます。これらのことから、輸送ATPアーゼ複合体が機能分化を起こし、より複雑な構成を持つV型ATPアーゼやATP合成酵素に進化したと考えられます。 続いて、解析した構造から輸送ATPアーゼ複合体の構造モデルを作成しました。このモデルは、べん毛輸送装置全体の低分解能電子顕微鏡トモグラフィー像とよく一致し、輸送装置におけるATPアーゼ複合体の各構成成分の位置や結合の仕方が明らかになりました(図4)。
● 本研究成果が社会に与える影響(本研究成果の意義)
O157のような病原性大腸菌、赤痢菌、サルモネラなど、病原性細菌の多くはIII型分泌装置を使って病原蛋白質をヒトや動物の細胞に直接送り込むことで感染します。従って、III型分泌のしくみを解明して病原蛋白質の輸送を阻害する薬剤を開発すれば、細菌を殺さず病原性のみを奪うことができます。III型分泌で重要なATP加水分解酵素-固定子複合体の詳細な構造を初めて明らかにした今回の成果は、III型分泌の解明に向けた大きな一歩であり、副作用が少なく耐性菌のできにくい感染症薬剤開発につながる成果でもあります。また、V型ATPアーゼにおいては、ATP加水分解サブユニットと外周固定子の原子レベルでの複合体構造は未知であり、がんや骨粗しょう症治療の標的となっているV型ATPアーゼの研究にも役立つ成果です。さらに、ATP合成酵素やA/V型ATPアーゼは多くの生物に普遍的に見られ、重要な生命機能を担っている複雑な分子集合体ですが、その起源についてはよくわかっていません。今回の成果は、ATP合成酵素やA/V型ATPアーゼの起源を探る上での大きな手がかりとなります。
● 特記事項
本研究は、科学研究費補助金の支援のもとに行われました。
【用語説明】
注1) ATP加水分解酵素…
エネルギーを蓄えている物質であるATPを加水分解してエネルギーを取り出す働きをもつ酵素のこと。
注2) ATP合成酵素…
生物に不可欠なATPをADPとリン酸から合成する酵素。細胞膜やミトコンドリアの膜の外から内に流れる水素イオンのエネルギーを使って合成する。約10種類の蛋白質が数十個組み合ってできた超分子複合体で、モーターのような回転機構を持つことで知られる。
注3) V型ATPアーゼ…
ATPの加水分解エネルギーを利用して細胞内の小器官内のpHを調節するために働くイオンポンプ。細胞内の老廃物を分解するリソソームや神経伝達ではたらくシナプスなど、酸性環境が必要な場所に存在する。約10種類の蛋白質が数十個組み合ってできた超分子複合体で、モーターのような回転機構を持ち、回転する部分を回転子、動かない部分を固定子と呼んでいる。ATP合成酵素に良く似ているが、主にATP合成酵素と逆の反応を行っている。
【参考図】
サルモネラや大腸菌は菌体から生えた数本のべん毛を回転させて泳ぎます。それぞれのべん毛の根元には回転モーターがあります。左はサルモネラの電子顕微鏡写真(スケールバーは2 mm)。 右はべん毛の模式図(CM:細胞膜; PG:ペプチドグリカン層; OM:外膜)。
輸送装置は、6種類の膜貫通型タンパク質(FlhA、FlhB、FliO、FliP、FliQ、FliR)でできた輸送ゲート複合体(青色の部分。分泌される蛋白質の通路となる)と3種類の可溶性タンパク質(FliH、FliI、FliJ)でできたATPアーゼ複合体(青色の下の緑色の部分。ATPのエネルギーを使って効率よく分泌を行う。)で構成されます。輸送装置を包むべん毛基部体のCリングの直径は約45 nm。(CM:細胞膜; PG:ペプチドグリカン層; OM:外膜)。
(A)FliH-FliI複合体の全体構造。2個のFliH分子を青色と桃色、FliIを緑色で表示。
(B)FliHの2量体とV型ATPアーゼ固定子の構造比較。左はFliHの2量体、右端はV型ATPアーゼ固定子(緑色:Eサブユニット、オレンジ色:Gサブユニット)、両者の重ね合わせを中央に表示。
(A)FliH-FliI複合体のリングモデル。輸送ATPアーゼ複合体中ではFliH-FliI複合体が6個あると考えられています(FliI分子を6、FliH分子を12含む)。各々のFliH-FliI複合体は別々の色で表示しています。
(B)(A)を下から見た図。
(C)べん毛輸送装置全体の低分解能電子顕微鏡トモグラフィー像にモデルを当てはめた図。今回の解析には含めなかったFliHの削った部分を緑色、FliJを桃色で表示。
(D)V型ATPアーゼとATP合成酵素の模式図。V型ATPアーゼではA,B,D,E,Gと標記されたサブユニット群、ATP合成酵素ではα,β,γ,δ,b2と標記されたサブユニット群が、輸送ATPアーゼ複合体のFliH、FliI、FliJに相当する。
|
【問い合わせ先】 大阪大学 大学院生命機能研究科 准教授 (SPring-8に関すること) |
- 現在の記事
- 細菌の分泌装置蛋白質の構造を原子レベルで解明!-生命に普遍的なATP合成酵素の起源は細菌の毛や毒針?- (プレスリリース)
 chem.sci.osaka-u.ac.jp
chem.sci.osaka-u.ac.jp