アミノ酸排出輸送タンパク質YddGがアミノ酸分子を輸送するしくみ(プレスリリース)
- 公開日
- 2016年06月01日
- BL32XU(理研 ターゲットタンパク)
平成28年5月31日
東京大学大学院理学系研究科
発表のポイント:
◆細胞内から細胞外にアミノ酸分子を輸送するタンパク質であるYddGの立体構造を解明しました。
◆アミノ酸分子が細胞膜を越えて排出されるメカニズムを世界で初めて原子分解能で明らかにしました。
◆本研究の成果は細胞が持つアミノ酸排出機構の理解につながるとともに、アミノ酸の工業生産の効率向上への寄与が期待されます。
|
アミノ酸は栄養源やタンパク質の材料として利用される、すべての生物にとって重要な分子です。細胞内のアミノ酸量は一定に保たれていますが、細菌の膜蛋白質であるYddGは、細胞内に過剰に蓄積したアミノ酸を細胞外へと排出することで、アミノ酸の過剰な蓄積を防ぐ役割を担っています。また、YddGを改変し多量にアミノ酸を排出できる細菌を作り出せれば、アミノ酸の工業生産に利用できる可能性があるため、応用面の観点からも注目を集めています。 発表雑誌 |
発表内容:
アミノ酸(注1)は栄養源やタンパク質の材料として利用される、すべての生物にとって重要な分子です。しかし有用なアミノ酸も、細胞内に過剰に蓄積すれば有毒であり、代謝阻害や細胞増殖阻害の原因となります。原核生物には、細胞内に過剰に蓄積したアミノ酸を細胞外へと排出することで、過剰な蓄積を防ぐ機構が存在しています。このアミノ酸分子の輸送には、アミノ酸排出輸送体と呼ばれる一群の膜輸送体(注2)タンパク質が関わっています。
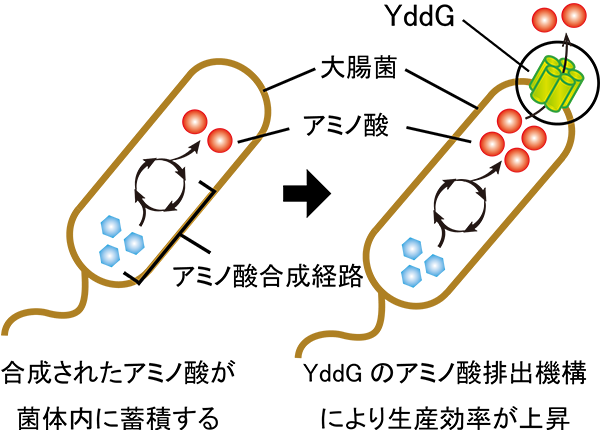
YddGはアミノ酸排出輸送体の一種として2007年に発見された膜タンパク質です。YddGの遺伝子を欠損した大腸菌では芳香族アミノ酸の細胞内への過剰な蓄積が見られたことから、YddGはフェニルアラニン(注3)等の芳香族アミノ酸を輸送する輸送体であると考えられていました。また、その排出機構を利用して、YddGは微生物を用いたアミノ酸の発酵生産(注4)において、芳香族アミノ酸の生産効率を上昇させるツールとして特許が取得されており、応用面でも注目を集めています (図1) 。
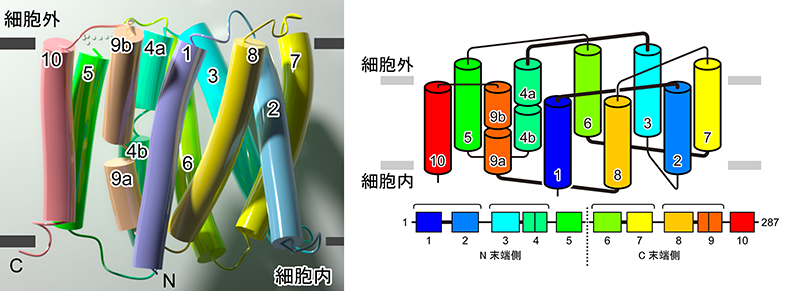
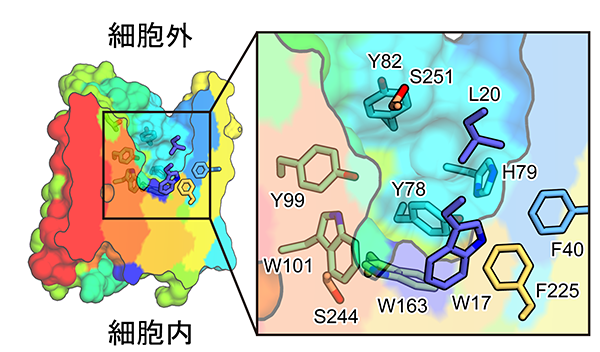
今回、東京大学大学院理学系研究科の濡木理教授、石谷隆一郎准教授らの研究グループは、味の素株式会社イノベーション研究所の臼田佳弘グループ長、福井啓太主任研究員らとの共同研究により、YddGによるアミノ酸排出機構を原子レベルで解明することを目的とし、YddGのX線結晶構造解析(注5)を試みました。大型放射光施設SPring-8(注6) BL32XUにおいて細菌Starkeya novella由来のYddGの結晶からX線回折データを収集した結果、2.4 Å(オングストローム、注7)という高分解能で立体構造を解明することに成功しました(図2)。構造解析の結果からは、YddGは10の膜貫通ヘリックス(注8)(TM1~10、図2)が擬2回対称(注9)を持ちつつ交互に配置するという、極めて特異な新規構造を有すること、さらには、これらの膜貫通ヘリックスに囲まれた中央部に大きなくぼみ(ポケット)が存在することが分かりました。このポケットの内部には、親水性アミノ酸残基であるヒスチジンを中心に形成された親水性領域と疎水性アミノ酸残基であるトリプトファンを中心に形成された疎水性領域が存在していました(図3)。構造情報に基づく生化学的解析により、YddGはポケット内部に形成した環境とポケットの大きさによってアミノ酸とそれ以外の物質を選択していることが示唆されました。一方で輸送基質に関しては、特定の種類のアミノ酸だけを輸送するのではなく、アミノ酸分子全般を輸送できることも明らかになりました。このことは、芳香族アミノ酸のみならず、他の種類のアミノ酸生産においても、YddGが生産効率上昇のためのツールとして利用できる可能性を示しています。また、ポケット内部の環境を変化させることで、アミノ酸のみならず、抗生物質などの有用物質の微生物を用いた工業的な発酵生産におけるツールとして応用できる可能性が考えられます。
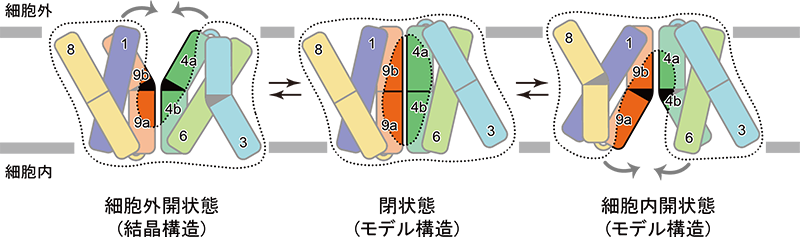
さらに研究グループはYddGがアミノ酸を輸送するメカニズムの解明も目指しました。構造情報に基づく生化学的解析を進めた結果、YddGはポケットを形成する4本の膜貫通へリックスが折れ曲がることで、「外側に開いた状態」、「閉状態」、「内側に開いた状態」の3つの状態を行き来し、アミノ酸を輸送するというYddGの構造変化モデルを提唱しました (図4) 。
今回提唱したYddGによるアミノ酸の輸送メカニズムは、これまで類似の報告が無い全く新規のものでした。さらに、このメカニズムを基にYddGを構成するアミノ酸残基に変異を導入し、アミノ酸輸送活性が上昇したYddGを作製、アミノ酸生産細菌に導入することによりアミノ酸の工業生産の効率向上につながることが期待されます。
【用語解説】
(注1) アミノ酸:
アミノ基とカルボキシル基の両方の官能基を持つ有機化合物の総称。特に狭義には生体のタンパク質の構成ユニットとなる20種類のアミノ酸をさす場合が多い。
(注2) 膜輸送体:
細胞の内外を隔てる細胞膜上に存在し、特定の物質を選択的に細胞膜の片側から反対側へと輸送する機能を持つタンパク質。通常、糖やアミノ酸、イオンといった物質は細胞膜を通り抜けることができず、膜輸送体を介して細胞内外を移動する。膜輸送体は、栄養分の細胞内への取り込みや、不要になった物質の細胞外への排出など、さまざまな役割を担っている。
(注3) フェニルアラニン:
アミノ酸の一種で、側鎖にベンジル基を持つ。必須アミノ酸であり栄養分として重要なだけでなく、甘味料アスパルテームの原料としても重要である。
(注4) アミノ酸の発酵生産:
従来、アミノ酸は天然のタンパク質の酸加水分解による抽出法により製造されてきたが、この方法では生産量に制限があった。また、合成法ではL体とD体のアミノ酸が同時に等量生成されるために、生成したD体のアミノ酸を再びL体に変換する工程が必要であった。微生物を用いた発酵法はアミノ酸を低コストで大量に生産できるメリットがあり、多くのアミノ酸の製法となっている。近年の研究から微生物が有する輸送体のアミノ酸排出活性が発酵生産の効率に重要であることが明らかになっている。
(注5) X線結晶構造解析:
タンパク質の立体構造を決定する手法の1つ。高純度に精製したタンパク質より調製したタンパク質の結晶に対しX線を照射し、得られた回折データを解析することでタンパク質の電子密度の情報を得ることができる。原子レベルでタンパク質の立体構造を明らかにできる手法であり、タンパク質の構造解析には最も一般的に用いられる。
(注6) SPring-8:
兵庫県にある世界最大級の大型放射光施設。非常に強いX線を用いた実験が可能。ビームラインのひとつBL32XUは、膜タンパク質などの高難度ターゲットの微小結晶からもデータ収集が可能な高フラックス・マイクロビームラインである。
(注7) オングストローム:
1 Å(オングストローム)は0.1 nm(ナノメートル)であり、ほぼ炭素と炭素の結合距離に相当する。
(注8) 膜貫通ヘリックス:
膜貫通型の膜タンパク質は膜を完全に貫通しているが、その膜貫通部位は基本的にβバレルあるいはαヘリックス構造をとる。特にαヘリックス構造をとった膜貫通部位のことを膜貫通ヘリックスと呼ぶ。
(注9) 擬2回対称
ある2つの物体について、片方を180度回転させるともう片方に厳密に重なる場合は2回対称性があるという。一方,両者に異なる部分もあるが似ている部分が多く大まかに重なる場合は、擬2回対称性があるという。
添付資料:
アミノ酸生産に用いられる大腸菌株は、菌体内にアミノ酸をより蓄積するよう代謝系が改変されています(左図)。この大腸菌にYddGを過剰発現させることで、さらにアミノ酸生産効率を上昇させることができます(右図)。
YddGは、これまで報告が無い新規な立体構造を持つことが明らかになりました。左が結晶構造をシリンダーモデルで示した図、右がYddGの膜貫通へリックスの配置を模式的に示した図です。
YddG分子表面モデルをポケットに沿って切断した断面図。今回解明した結晶構造では、ポケットは細胞外側に開いていました。右図はポケット周囲を拡大したものです。ポケット内部に張り出したこれらのアミノ酸残基により、ポケット内部の環境が形成されています。
推定されるYddGの構造変化サイクルの模式図。YddGがこのような構造変化を起こすことでアミノ酸分子を細胞内側から細胞外側へ輸送していると考えられます。
|
【問い合わせ先】 (報道に関すること) (SPring-8に関すること) |
- 現在の記事
- アミノ酸排出輸送タンパク質YddGがアミノ酸分子を輸送するしくみ(プレスリリース)
 bs.s.u-tokyo.ac.jp
bs.s.u-tokyo.ac.jp