病原菌が鉄を細胞内に取り込む仕組み -細胞膜で働くヘム輸送体タンパク質の立体構造を解明-(プレスリリース)
- 公開日
- 2016年11月10日
- BL26B2(理研 構造ゲノムII)
- BL41XU(構造生物学I)
2016年11月8日
理化学研究所
兵庫県立大学
理化学研究所(理研)放射光科学総合研究センター城生体金属科学研究室の直江洋一特別研究員(研究当時)、中村希研修生(研究当時)、城宜嗣主任研究員(兵庫県立大学大学院生命理学研究科教授)、杉本宏専任研究員らの研究チームは、病原菌が増殖に必要な鉄を自身の細胞内に取り込む際に機能するタンパク質の立体構造を原子レベルで解明しました。これにより、病原菌が効率的に鉄を細胞内へと輸送する仕組みが明らかになりました。 原論文情報 |
背景
鉄は、ヒトなどの動物や細菌を含めたほぼ全ての生物にとって重要な元素です。食べ物から吸収した鉄分は、体中の細胞へ運ばれてさまざまなタンパク質と結合した状態になります。例えば、ヘモグロビンとして血液中で酸素の運搬を行ったり、細胞が呼吸をするのに使われたり、ホルモンの合成反応に関わるなどの役割を担っています。
また、鉄は病原菌の生存や増殖にも利用されています。ヒトの体内の鉄は大半が「ヘム」という化合物の形で血液中のヘモグロビンの中に存在し、病原菌はヒト(宿主)の血液から鉄を獲得しています。鉄の獲得は、「ヘムの奪取→ヘムの輸送→鉄の取り出し」というステップからなっています。ヘムを病原菌の細胞膜の外側から内側の細胞質へ輸送する役割を担っているのは、細胞膜を貫通している「ヘムトランスポーター(ヘム輸送体)」というタンパク質です。
これまで、ヘムトランスポーターがヘムを細胞内へと運ぶ際には、アデノシン三リン酸(ATP)という生体エネルギーを利用して、分子構造を大きく変化させることが分かっていました。しかし、実際にヘムトランスポーターにどのような構造変化が起こり、どのようにヘムが運ばれるのかについての詳細な仕組みは分かっていませんでした。
研究手法と成果
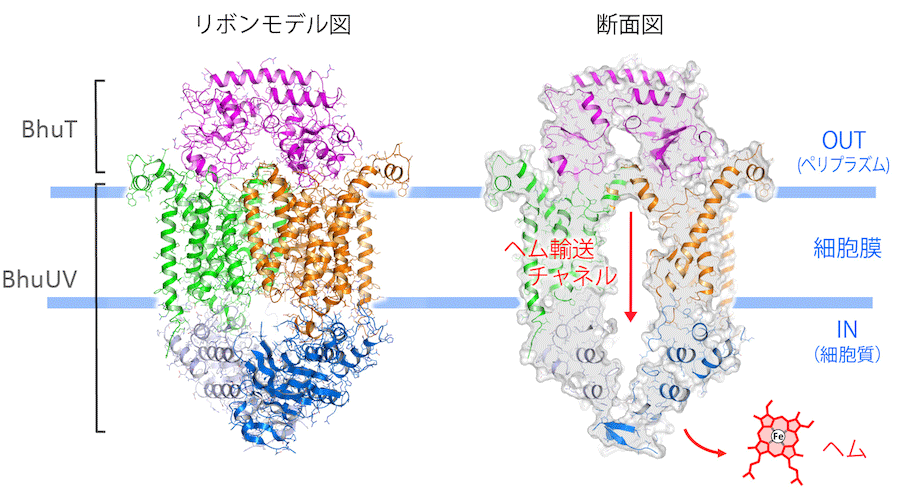
研究チームはまず、病原性バクテリアのバークホルデリア セノセパシア菌[6]が持っているヘムトランスポーター(BhuUV)を高い純度で調製しました。調製したBhuUVと、ヘムをBhuUVへと受け渡す役割を担うヘム結合タンパク質(BhuT)との複合体の状態で結晶化しました。その結晶に大型放射光施設「SPring-8」の高輝度X線ビームを照射して測定したデータを解析することで、3.2オングストローム(Å、1Åは100億分の1メートル)の分解能でタンパク質の各原子の位置を詳細に調べ、立体構造を解明しました(図1)。
その結果、ヘムトランスポーターの細胞膜を貫通している部分は、20本のヘリックス(らせん)構造で構成され、その中央には縦に細長い空洞状のヘム輸送経路(チャネル)が存在することを発見しました。このチャネルは、輸送されるヘムの出口となる細胞の内側(細胞質側)に大きく開いた状態の構造(内開き構造)でした。ヘムを運ぶ前の状態では、チャネルの出口は閉じているので、これは、この構造がヘムを輸送した直後の状態であることを示しています。
左: タンパク質を構成するポリペプチド鎖をリボンで示したモデル。ヘム結合タンパク質(BhuT)が、ヘムトランスポーター(BhuUV)に結合してヘムを受け渡す。20本のヘリックス(らせん)構造が細胞膜を貫通する部分(緑または茶色)を形作り、それらの構造変化によってヘムが細胞質へ輸送されると考えられる。
右: 左の分子の断面。細胞膜を貫通する部分の中央には縦に「チャネル」と呼ばれる細長い空洞があり、細胞質側へ出口が開いた状態にある(内開き構造)。ヘムは、このチャネルを通って細胞内へ輸送されると考えられる。
これまでに国外の研究グループによって、他の病原菌が持つヘムトランスポーターや、ビタミンB12を輸送する機能を持つ同じファミリーのタンパク質 (Ⅱ型ABCインポーター)の構造解析が報告されていましたが、それらはチャネルの出口が閉じている状態の構造情報しか得られていませんでした。今回、ヘムを輸送した直後のチャネルの出口が開いた状態の立体構造を捉えることに成功したことから、輸送を行う際のトランスポーター全体の動きを予測できるようになりました。
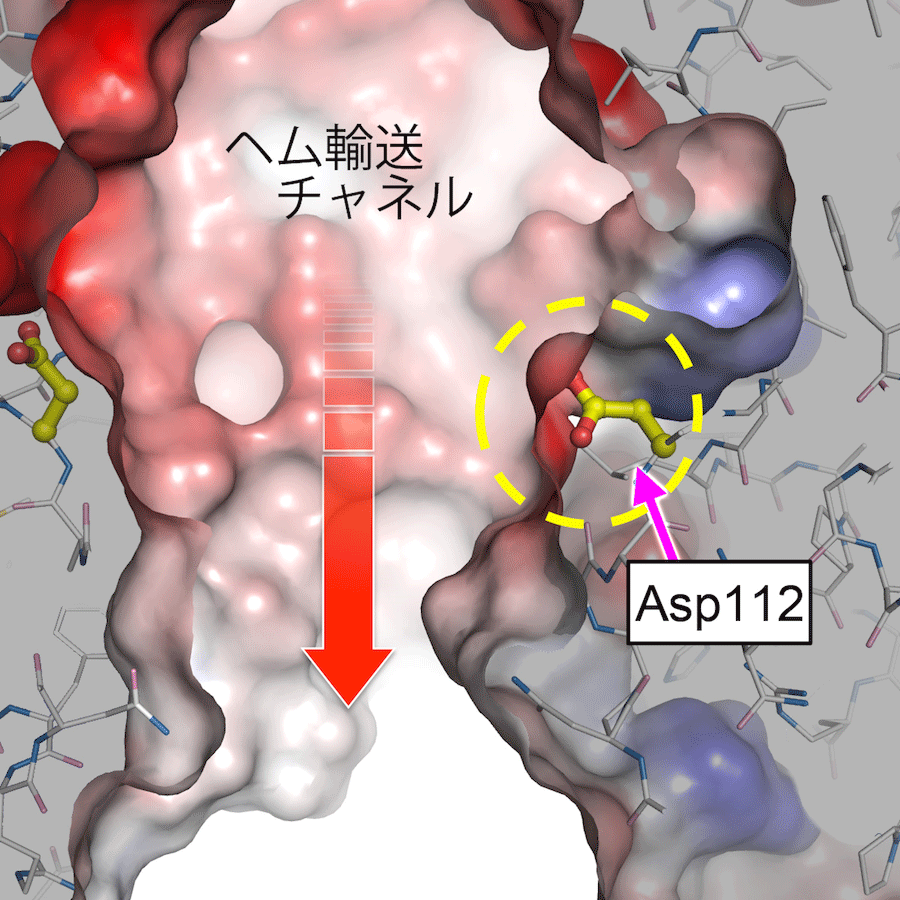
また、ヘムを輸送するチャネルの表面には、アスパラギン酸残基(Asp112)によって負に荷電する部位(-COO-)があり、その露出度がヘムトランスポーター全体の構造変化によってうまく制御されていることを突き止めました(図2)。つまり、ヘムがチャネルの内部に取り込まれた後、チャネルの表面に露出した負電荷が、ヘムが持つ負電荷の部分と“反発”します。そのため、ヘムは速やかにヘムトランスポーター分子の出口から細胞質内に運ばれると考えられます。
ヘムトランスポータータンパク質の分子表面を示した構造図。負電荷を持つ部分を赤、正電荷を持つ部分を青で示している。チャネルが細胞質側に開いている状態ではアスパラギン酸側鎖(Asp112)が露出している。この部分が負電荷を持つことから(赤色)、ヘムの負電荷の部分と反発することで、ヘムは速やかに細胞内に運ばれると考えられる。
さらに、ヘムトランスポーターがヘムを細胞内へ運ぶ際には生体エネルギーであるアデノシン三リン酸(ATP)がヘムトランスポーターに結合して分解されることが分っていましたが、輸送サイクルのどの段階でどのように利用されるのか不明でした。そこで生化学的な実験を行った結果、ヘムトランスポーター(BhuUV)が結合タンパク質(BhuT)を解離して構造を初期状態にリセットするために、ATPの結合が必要であることが分かりました。
今回明らかにした立体構造と機能解析の結果から、ヘムの輸送を担う膜を貫通しているヘリックス(図1)の大規模な再配置によってチャネル出口が開閉する仕組みが分かりました。
今後の期待
本研究で、病原菌の細胞膜の中で働いているタンパク質であるトランスポーターがその機能を発揮する際には、大規模な構造変化を伴うことが明らかになりました。しかし、それは連続的な変化の中の一部分を解明したに過ぎません。今後は、ヘムトランスポーター中の各原子が動いていく様子を、実験で連続的に捉えるような解析へ展開していく必要があります。また、得られた構造データはスーパーコンピュータを利用した分子動力学計算[7]をより有効に活用できることから、理論的な検証に基づいた構造変化の解析も進めていく計画です。
さらに、病原菌の鉄獲得メカニズムの解明は、感染症に対する新しい治療手段の開発に貢献する可能性があります。ヒトと病原菌間の鉄争奪戦の仕組みを原子レベルで詳細に解明できれば、それらの構造情報が新薬の開発につながると期待できます。
補足説明
[1] ヘモグロビン
鉄を含む「ヘム」という赤い色素と「グロビン」というタンパク質からできている複合タンパク質で、赤血球中に存在する。ヘモグロビンは肺で酸素と結合し、全身の組織へ酸素を運搬する役割を担う。
[2] ヘム
鉄イオンを中心にポルフィリンという環状の有機化合物が取り囲んだ物質。生体内ではヘモグロビン、ミオグロビン、異物薬物代謝酵素(シトクロムP450)、ペルオキシダーゼ、電子伝達系酵素をはじめとするさまざまなタンパク質の補欠分子族(酵素の活性に不可欠な非タンパク質性の物質)として機能している。
[3] アデノシン三リン酸(ATP)
細胞の中でエネルギーを蓄えている物質。体に必要な生理物質を合成したり、輸送したり、筋肉を動かしたりといった生命活動を行う際に、生物はアデノシン三リン酸を分解して無機リン酸を放出する反応を利用してタンパク質の構造変化を駆動している。ATPはadenosine triphosphateの略。
[4] 大型放射光施設「SPring-8」
兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設。SPring-8の名前はSuper Photon ring-8 GeVに由来する。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する、細く強力な電磁波のこと。SPring-8の場合、遠赤外から真空紫外、軟X線、X線を経てガンマ線に至る幅広い波長域の放射光が得られる。
[5] アスパラギン酸残基
タンパク質はたくさんのアミノ酸がペプチド結合でつながった物質で、20種類のアミノ酸から構成される。アスパラギン酸はアミノ酸の一つで、AspまたはDと表記する。タンパク質の中では、元のアミノ酸にあたる部分(ペプチド結合以外のアミノ酸構造)を残基と呼ぶ。アスパラギン酸はカルボキシル基 (-COOH)を持っているため、生体条件化でマイナス電荷を持つ酸性アミノ酸に分類される。
[6] バークホルデリア セノセパシア菌
Burkholderia cenocepacia。日和見感染性の細菌で、呼吸器感染症を引き起こす。多剤耐性を持つため感染すると治療が困難となる。特に嚢胞性繊維症の患者において重大な肺疾患をもたらして死因となることがある。
[7] 分子動力学計算
原子間に働く力を計算し、運動方程式を繰り返し解くことによって、分子・原子の動きを追跡してシミュレーションを行う方法。
|
お問い合わせ先 <機関窓口> 兵庫県立大学 経営部総務課 (SPring-8 / SACLAに関すること) |
- 現在の記事
- 病原菌が鉄を細胞内に取り込む仕組み -細胞膜で働くヘム輸送体タンパク質の立体構造を解明-(プレスリリース)
 spring8.or.jp(杉本)
spring8.or.jp(杉本)