X線自由電子レーザーの創薬利用が前進 -タンパク質-リガンド複合体微結晶による創薬が可能に-(プレスリリース)
- 公開日
- 2017年07月31日
- SACLA BL3
2017年7月28日
理化学研究所
高輝度光科学研究センター
理化学研究所(理研)放射光科学総合研究センターの内藤久志先任研究員と国島直樹グループディレクターらと高輝度光科学研究センター(JASRI)の共同研究グループ※は、X線自由電子レーザー(XFEL)[1]施設「SACLA[2]」を用いた「連続フェムト秒結晶構造解析(SFX)[3]」という手法を使い、創薬におけるXFELの有用性を示しました。 論文情報 |
| ※共同研究グループ | |
| 理化学研究所 放射光科学総合研究センター | |
| 利用システム開発研究部門 生物試料基盤グループ | |
| グループディレクター | 国島 直樹 (くにしま なおき) |
| 先任研究員 | 内藤 久志 (ないとう ひさし) |
| リサーチアソシエイト | 松浦 祥悟 (まつうら よしのり) |
| 利用技術開拓研究部門 SACLA利用技術開拓グループ | |
| グループディレクター | 岩田 想 (いわた そう) |
| 上級研究員(研究当時) | 田中 里枝 (たなか りえ) |
| 研究員(研究当時) | 南後 恵理子(なんご えりこ) |
| 特別研究員(研究当時) | 菅原 道泰 (すがはら みちひろ) |
| 特別研究員(研究当時) | 小林 淳 (こばやし じゅん) |
| リサーチアソシエイト(研究当時) | 田中 智之 (たなか ともゆき) |
| XFEL研究開発部門 ビームライン研究開発グループ | |
| グループディレクター | 矢橋 牧名 (やばし まきな) |
| データ処理系開発チーム | |
| チームリーダー | 初井 宇記 (はつい たかき) |
| 高輝度光科学研究センター XFEL利用研究推進室 | |
| 先端光源利用研究グループ 実験技術開発チーム | |
| チームリーダー | 登野 健介 (との けんすけ) |
| 先端計測・解析技術グループ | |
| 高度データ解析チーム | |
| チームリーダー | 城地 保昌 (じょうち やすまさ) |
| 計測技術開発チーム | |
| 研究員 | 亀島 敬 (かめしま たかし) |
背景
X線結晶構造解析[7]により得られる原子レベルでのタンパク質立体構造は、タンパク質の機能を解明するための重要な情報源の一つです。しかし、放射光(SR:Synchrotron Radiation)などを用いた従来の結晶構造解析では、結晶の放射線損傷[8]を防ぐため抗凍結処理した結晶を使って100 K(約-173 ℃)程度の低温条件で回折データを測定するため、抗凍結処理条件によって解析結果に違いが出ることがあります。
X線自由電子レーザー(XFEL)は超高強度かつ超短パルスのX線レーザーで、試料が壊れる前にX線損傷のない回折データを取得できるという特長があります。さらに、このXFELによる連続フェムト秒結晶構造解析(SFX)を使うと、生理的な条件に近い室温の結晶構造が得られます。従って、生理的条件に近い構造をもとに創薬のための化合物を設計することが可能となるため、「構造に基づく薬物設計(SBDD)」にとって大きな利点となる可能性があります。
SBDDでは、タンパク質と創薬候補の低分子化合物(リガンド)の複合体の結晶構造が必要です。そのタンパク質-リガンド複合体の結晶は一般的に、リガンド化合物を含む水溶液にタンパク質結晶を浸す「ソーキング法」によって調製します。しかし、数マイクロメートル(μm、1 μmは1,000分の1 mm)サイズのタンパク質微結晶を使うSFXにおいて、ソーキング法が適用できるかどうかはこれまで検討されていませんでした(SRでは50~100 μmサイズの結晶を使用)。また、SFXでは微結晶を安定してXFELビーム位置に導入するために、高粘度の微結晶媒体を用います。現状では油性媒体(グリース)注1)と水性媒体(ヒドロキシエチルセルロース)注2)の2種類がありますが、ソーキング法で調製した複合体に適するかどうかも、検証されていませんでした。
そこで共同研究グループは、SFXの創薬利用の可能性を探るため、モデルタンパク質を用いてSFXによるタンパク質-リガンド複合体の微結晶構造解析を試みました。
注1) 2014年11月11日 プレスリリース「連続フェムト秒結晶構造解析のための結晶供給手法を開発」
注2) 2017年4月10日 プレスリリース「低ノイズ・低粘着性・低コストのタンパク質結晶輸送媒体を発見」
研究手法と成果
共同研究グループは、SFXで実績のあるサーモリシンというタンパク質を用いて、サーモリシン-リガンド複合体の微結晶構造解析を行うことにしました。リガンドを結合していないサーモリシン微結晶のSFX構造は、米国のグループが報告しています注3)。ただし、このLCLS[9]で行われたSFX実験は真空中で実施したため、測定温度は不明です。また、サーモリシン-リガンド複合体の構造解析は米国の別のグループから報告されていますが注4)、従来のSRを用いた低温条件での測定でした。
本研究ではまず、リガンドにZA(N-Carbobenzoxy-L-aspartic acid)を用い、ソーキング法でサーモリシン-リガンド複合体微結晶(図1)を調製し、SACLA のビームライン(BL3)でSFX実験を行いました。実験は大気中で行い、測定温度は室温(300 K、約27 ℃)でした。微結晶媒体は油性・水性の2種類を試しました。また、SRを用いた通常のクライオ法[10](測定温度100 K、約-173 ℃)による結晶構造解析も行い、化合物の結合様式などに違いがあるかどうか統計的な検討も含め詳細に調べました。
今回のSFX実験に用いたタンパク質サーモリシン-リガンド複合体微結晶の顕微鏡写真。米粒型のものが微結晶で、平均的なサイズは4×4×8 μmほどである。
その結果、一般的なソーキング法によりサーモリシン-リガンド複合体のSFX構造を得ることができました(図2)。また、SFXの微結晶媒体として、油性および水性の媒体いずれを用いた場合も同じ構造が得られました。
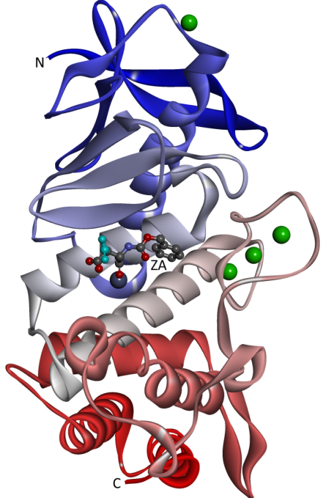
今回のSFX実験で得られたサーモリシン-リガンド複合体の全体構造を示す。低分子化合物のリガンドであるZA(N-Carbobenzoxy-L-aspartic acid)が、サーモリシン分子中央に存在する活性部位ポケットに結合している。ZAの水色の部分は図3における水色部分(B)と対応している。
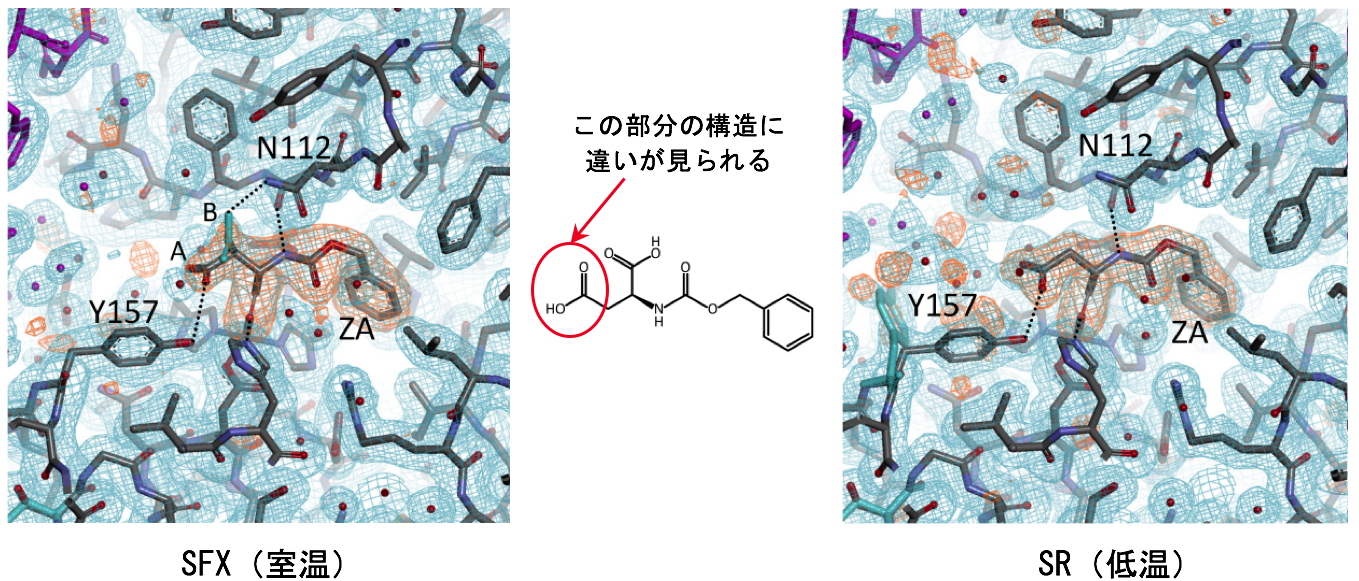
さらに、SFX(室温)とSR(低温)の構造を比較したところ、両者には格子定数[11]、結晶水の位置および数、アミノ酸側鎖の構造多様性、リガンド認識様式において、明らかな違いが認められました。これらの点において、SRではクライオ条件の違いに依存して得られる結果に違いがみられましたが、SFXでは再現性よく同じ結果が得られました。SFXの室温構造で観察されたリガンド認識様式は、SRの低温構造では得られませんでした(図3)。具体的には、低分子化合物リガンドZAの一部(図3の赤丸で示した部分)において、SFXでは二つの立体配置を交互にとる「交互立体配座[12]」がみられましたが、SRではみられませんでした。このSFXとSRの構造の違いの原因としては、測定温度、クライオ処理、放射線損傷などの影響が考えられます。
今回の実験で得られたサーモリシン-リガンド複合体におけるリガンド結合部位の拡大図を示す。左右がそれぞれSFX(室温)とSR(低温)から得られた構造である。中央に示した低分子化合物リガンドZAの化学構造において、赤丸で示した部分(カルボキシ基)の構造に違いがみられる。すなわち、SFX構造ではAとB(水色)の二つの立体配置を交互にとる「交互立体配座」が観測され、AとBの割合は約6:4であった。
注3)Hattne et al. (2014) "Accurate macromolecular structures using minimal measurements from X-ray free-electron lasers" Nature Methods 11, 545–548
注4)Birrane et al. (2014) "Synthesis of Aspartame by Thermolysin: An X-ray Structural Study" ACS Med. Chem. Lett. 5, 706–710
今後の期待
今回の研究により、SFXによるタンパク質-リガンド複合体の微結晶構造解析は一般的なソーキング法で実行でき、室温の生理的条件に近い構造を高い再現性で得られることが分かりました。今後、SFXがSBDDにおける化合物探索に役立つツールとして確立することで、製薬企業などによるXFEL利用が進むことが期待できます。
補足説明
[1] X線自由電子レーザー(XFEL)
X線自由電子レーザーとは、X線領域におけるレーザーのこと。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とするため、原理的な波長の制限はない。XFELはX-ray Free Electron Laserの略。
[2] SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本で初めてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAser の頭文字を取ってSACLAと命名された。2011年6月に最初のX線レーザーを発振、2012年3月から共用運転が開始され、利用実験が始まっている。大きさが諸外国の同様の施設と比べて数分の1と、コンパクトであるにも関わらず、 0.1ナノメートル(100億分の1m)以下という世界最短波長のレーザーの生成能力を有する。
[3] 連続フェムト秒結晶構造解析(SFX)
多数の微結晶を含む液体などをインジェクター(噴射装置)から噴出しながら、X線レーザーを照射し結晶の構造を解析する手法。配向の異なる多数の微小結晶からの回折イメージを連続的に収集する。SFXはSerial Femtosecond Crystallographyの略。
[4] 放射光
相対論的な荷電粒子(電子や陽電子)が磁場で曲げられるとき、その進行方向に放射される電磁波。放射光は明るく、指向性が高く、また光の偏光特性を自由に変えられるなどの優れた特徴を持つ。
[5] 構造に基づく薬物設計(SBDD)
ある疾病に関連するタンパク質について立体構造が決定された場合、結合することによってそのタンパク質の働きを調節する低分子化合物(リガンド)をタンパク質の立体構造情報に基づいて設計する薬物設計の手法。ある程度の効能を持つリガンドが得られている場合、そのリガンドとタンパク質との複合体の立体構造情報を利用すれば、さらに効能の高いリガンドを合理的に設計することができる。SBDDはStructure-Based Drug Designの略。
[6] SPring-8
兵庫県播磨科学公園都市にある世界最高性能の放射光を生み出す、理化学研究所の大型放射光施設。その運転と利用者支援は高輝度光科学研究センター(JASRI)が行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来する。
[7] X線結晶構造解析
タンパク質の結晶を作製し、その結晶にX線を照射して得られる回折データを解析することにより、タンパク質の内部の原子の立体的な配置を調べる方法。この方法によって、タンパク質の立体構造や内部構造を知ることができる。
[8] 放射線損傷
X線の持つエネルギーによって、X線と相互作用した分子が壊れること。X線との相互作用で分子が壊れる場合だけでなく、分子が壊れる過程で生じる電子や、壊れた分子から生成する反応性の高い分子が観察対象の分子と化学反応する場合もある。一般的にタンパク質結晶の放射線損傷は、X線と水の相互作用をきっかけに、X線照射後ピコ秒(1ピコ秒は1兆分の1秒)の時間スケールで、水から生成する反応性の高い分子がタンパク質と化学反応することで起きる。
[9] LCLS
米国スタンフォード線形加速器センター(現在のSLAC国立加速器研究所)で建設された世界で初めてのXFEL施設。Linac Coherent Light Sourceの頭文字をとってLCLSと呼ばれている。2009年12月から利用運転が開始された。
[10] クライオ法
X線結晶構造解析において、試料結晶の温度を100 K程度の低温に保った状態で回折データを取得することで結晶の放射線損傷を防ぐ方法。
[11] 格子定数
結晶格子の大きさと形を決める定数。
[12] 交互立体配座
結晶構造において同一原子(群)の立体配置が複数重なって観測される現象。それらの立体配置がエネルギー的に同程度安定な場合に起こる。
発表者・機関窓口 <機関窓口> (SPring-8 / SACLAに関すること) |
- 現在の記事
- X線自由電子レーザーの創薬利用が前進 -タンパク質-リガンド複合体微結晶による創薬が可能に-(プレスリリース)

 riken.jp
riken.jp