病原性大腸菌がヒト腸管に付着する仕組みを解明 ―抗生物質に代わる新規感染症対策につながる研究成果―(プレスリリース)
- 公開日
- 2018年06月29日
- BL26B1(理研 構造ゲノムI)
- BL26B2(理研 構造ゲノムII)
- BL38B1(構造生物学III)
2018年6月27日
国立大学法人 大阪大学
研究成果のポイント
• 発展途上国で深刻な問題となっている腸管毒素原性大腸菌(※1)がヒトの腸管に付着する仕組みを解明しました。
• 腸管毒素原性大腸菌の付着には、菌の表面に存在するIV型線毛(※2)という糸状の構造物と腸管に放出する分泌タンパク質の両方が必要であることを明らかにしました。
• 明らかにした付着機構は、コレラ菌(※3)など他の多くの病原性細菌においても共通していました。
• 分泌タンパク質に対する抗体を投与すると、大腸菌が細胞に付着しなくなりました。分泌タンパク質を標的とすることで新たなワクチンの開発や、病原性細菌を腸管に付着させずに排出させるような治療法が可能となります。
大阪大学微生物病研究所の中村昇太特任准教授(常勤)、大阪大学大学院薬学研究科の沖大也大学院生、河原一樹助教、大久保忠恭教授らの研究グループは、病原性を有する大腸菌がIV型線毛と分泌タンパク質を利用して腸管に付着する仕組みを世界で初めて明らかにしました(図1)。本研究成果は、新たなワクチンの開発や、抗生物質に代わる新規治療薬の開発につながることが期待されます。 本研究成果は、米国科学アカデミー紀要「PNAS」オンライン版に、6月26日(火)午前4時(日本時間)に公開されました。 論文情報 |
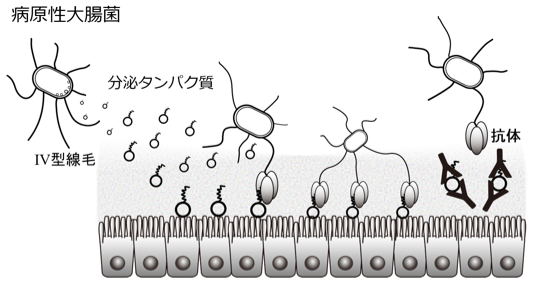
図1.腸管病原性大腸菌がヒト腸管に付着する様子。
研究の背景
腸管毒素原性大腸菌は、旅行者や発展途上国で生活する人々の下痢症の主な原因菌として知られており、世界保健機関(WHO)の統計によれば年間約30~50万人の死者を出す深刻な問題となっています(※4)。現在までに、腸管毒素原性大腸菌に対して有効なワクチンは開発されておらず、対症療法や抗生物質などに頼った治療が施されていますが、薬剤耐性菌の出現が社会問題となるなど、新たな治療法の開発が求められています。
腸管毒素原性大腸菌は、ヒトに感染するための最も重要なステップとして腸管に付着する必要があります。これまでの研究から、IV型線毛という細菌表面に存在する糸状の構造物が重要であると考えられてきましたが、その詳しい付着の仕組みについては解明されていませんでした。これに対し私たちは、腸管毒素原性大腸菌のヒト腸管への付着機構を解明し、その付着を阻害することで、抗生物質に頼らない新規の治療法の開発を目指して取り組んでいます。
本研究の成果
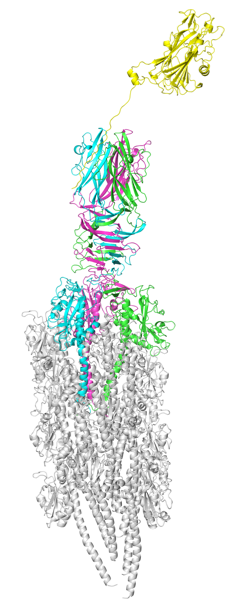
本研究では、腸管毒素原性大腸菌の付着にはIV型線毛だけでは不十分であり、大腸菌が腸管に放出する分泌タンパク質も必要であることを発見しました。また、X線結晶構造解析法(※5)という手法で線毛の先端部にのみ存在するタンパク質と、大腸菌が腸管に放出する分泌タンパク質がどのように結合しているのかを原子レベルで解明し(図2)、菌体表面のIV型線毛とヒト腸管上皮の間を分泌タンパク質が“橋掛け”する、腸管毒素原性大腸菌の付着機構を世界で初めて明らかにしました。さらに、分泌タンパク質に対する抗体を投与すると、大腸菌が細胞に付着しなくなることを明らかにしました。
本研究成果が社会に与える影響
本研究成果により、腸管毒素原性大腸菌がヒトの腸管に付着する仕組みが世界で初めて明らかとなりました。さらに、この付着モデルは、コレラ菌などの他の病原性細菌にも共通していることが分かりました。これらの成果は、腸管毒素原性大腸菌の新規ワクチン開発につながるだけでなく、付着に関与するタンパク質の結合を阻害する抗付着剤の開発につながる可能性があります。抗付着剤は、病原菌を死滅させず体外に洗い流すことができるため、耐性菌を出現させる恐れがありません。そのため、抗生物質とは異なる新規の治療法となる可能性があります。
特記事項
本研究成果は、2018年6月26日(火)午前4時(日本時間)に米国科学アカデミー紀要「PNAS」(オンライン)に掲載されました。
“Interplay of a secreted protein with type IVb pilus for efficient enterotoxigenic Escherichia coli colonization”「IVb型線毛と分泌タンパク質の相互作用を介した毒素原性大腸菌の効率的な定着」
Hiroya Oki*, Kazuki Kawahara*, Takahiro Maruno, Tomoya Imai, Yuki Muroga, Shunsuke Fukakusa, Takaki Iwashita, Yuji Kobayashi, Shigeaki Matsuda, Toshio Kodama, Tetsuya Iida, Takuya Yoshida, Tadayasu Ohkubo, and Shota Nakamura(*:筆頭共著者)
なお、本研究は、大型放射光施設SPring-8(課題番号:2015A1101, 2015B2101, 2016A2569, 2016B2569)の利用、及び京都大学生存圏研究所の今井友也准教授の協力を得て行われました。
図2.IV型線毛に分泌タンパク質(黄色)が結合した構造
用語説明
※1 腸管毒素原性大腸菌 (ETC)
病原性を有する大腸菌の一種。汚染された水や食物を介してヒトの腸管内に侵入し、易熱性毒素(LT)と耐熱性毒素(ST)の二種類の毒素を放出することで、水溶性の下痢を引き起こす。
食中毒の原因菌として知られるO-157は、ETCとは異なる腸管出血性大腸菌(Enterohemorrhagic Escherichia coli ; EHEC)に分類される。
※2 IV型線毛
様々な種類のグラム陰性菌に見られる菌体表面の構造物であり、標的への付着や感染、運動、バイオフィルム形成、DNAの取り込みなど、多種多様な機能を有する。
※3 コレラ菌
グラム陰性桿菌細菌の一種。O1およびO139血清型がコレラ毒素産生株として知られており、腸管毒素原性大腸菌と同様に汚染水を介して取り込まれ、水溶性下痢症の原因となる。
※4 出典:WHO下痢症情報サイト
http://www.who.int/topics/diarrhoea/en/
※5 X線結晶構造解析法
タンパク質の構造を解析する手法の一つ。解明したいタンパク質の結晶に対して強力なX線を照射し、その回折パターンを解析することで、結晶を構成するタンパク質の構造を知ることができる。
本件に関する問い合わせ先 大阪大学 大学院薬学研究科 高分子化学分野 (SPring-8 / SACLAに関すること) |
- 現在の記事
- 病原性大腸菌がヒト腸管に付着する仕組みを解明 ―抗生物質に代わる新規感染症対策につながる研究成果―(プレスリリース)
 gen-info.osaka-u.ac.jp
gen-info.osaka-u.ac.jp