植物フィトクロムAの構造変化を可視化 -植物光形態形成における分子機構の一端を解明-(プレスリリース)
- 公開日
- 2021年02月26日
- BL40B2(構造生物学II)
2021年2月26日
理化学研究所
理化学研究所(理研)放射光科学研究センター生命系放射光利用システム開発チームの大出真央研修生(研究当時、現理研開拓研究本部杉田理論分子科学研究室基礎科学特別研究員)と中迫雅由客員主管研究員は、植物の発芽などの光形態形成[1]を制御する色素タンパク質[2]「フィトクロムA」の全体構造と、光によって引き起こされるその構造変化を、X線小角散乱法[3]によって明らかにしました。 本研究成果は、植物による光環境応答の分子メカニズムを明らかにするための新たな基軸と展開の端緒を与えると期待できます。 今回、研究チームは、大型放射光施設「SPring-8」[5]でフィトクロムA のPr型とPfr型それぞれのX線小角散乱データを取得しました。X線小角散乱データの解析では、これまでに独自に開発した多変量解析[6]を用いた構造モデル分類法を適用しました。その結果、Pr型とPfr型の分子構造を可視化することに成功し、Pr型とPfr型の間で大規模な構造変化が生じていることが明らかになりました。さらに、類縁タンパク質であるフィトクロムBの部分構造に対して基準振動解析[7]を行った結果、光受容領域に内在する運動が光照射によって増幅され、核内移行や他のタンパク質との相互作用が生じるものと推定されました。 【論文情報】 |
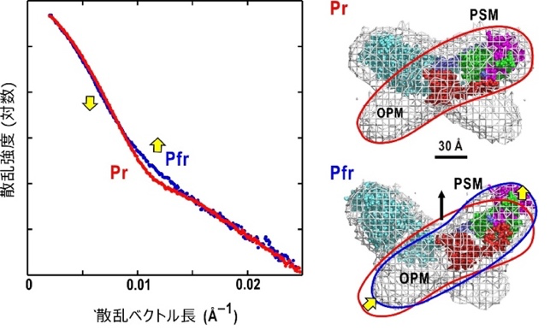
フィトクロムAからのX線小角散乱プロファイル(左)と推定された各状態の構造と構造変化(右)
研究支援
本研究は、文部科学省(MEXT)科学研究費補助金 新学術領域研究「蛋白質機能を駆動する水和構造の時空間階層イメージング」の支援を受けて実施されました。
背景
固着生活を営む植物は、適切な光合成環境を自ら獲得するために、光環境に敏感に反応する分子システムを備えています。このシステムには、赤色光-遠赤色光可逆応答をつかさどるタンパク質フィトクロムと、光屈性などを制御する青色光受容タンパク質フォトトロピン[8]が知られています。
レタスの種に赤色光を照射すると発芽しますが、赤色光の後に遠赤色光を照射すると発芽しません。このような発芽の性質を調べたバトラーらにより、1959年に赤色光と遠赤色光で可逆的に吸収変化を示す色素タンパク質として「フィトクロムA」が同定されました。現在、高等植物には、アミノ酸配列とその作用機序が異なるフィトクロムA~Eが存在することが知られており、それらは花芽形成や避陰反応[9]など、私たちが目にする植物のさまざまな光形態形成に関わることが明らかになっています。また、細菌や藍藻にも、高等植物のフィトクロムに類似した色素タンパク質が存在することが知られています。
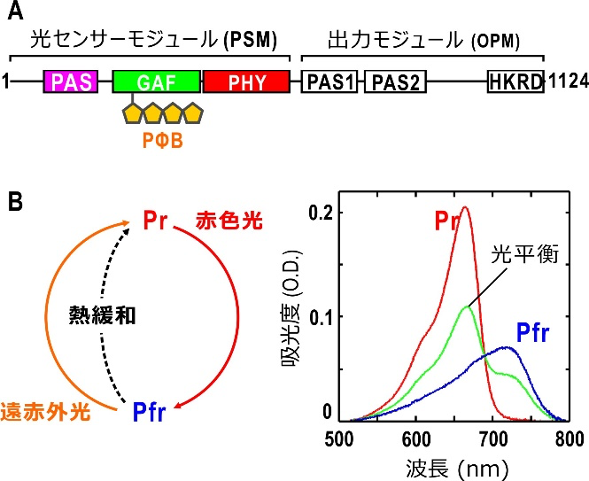
フィトクロムAは約1,100個のアミノ酸で構成されており、その配列から、フィトクロムAの前半分はフィトクロモビリンと呼ばれる色素を結合して光センサーモジュールを構成します(図1A)。また、後ろ半分は出力モジュールと呼ばれるリン酸化酵素のアミノ酸を含み、光に依存して酵素活性が現れます(図1A)。そのため、フィトクロムAは、光で制御できるリン酸化酵素といえます。光センサーモジュールは、赤色光吸収型(Pr型)と遠赤色光吸収型(Pfr型)の間を可逆的に光変換します(図1B)。
Pr型のフィトクロムは細胞質内に存在しますが、Pfr型になると分子内部に構造変化が生じて他のタンパク質分子との相互作用が可能となり、細胞核に移行して、フィトクロム相互作用因子タンパク質などと結合して遺伝子の発現を制御します。しかし、高等植物のフィトクロムの立体構造はいまだ原子レベルで解明されておらず、具体的な伝達機構は不明です。
図1 フィトクロムAの機能ドメイン配置と光反応
A: 全長1124残基からなるエンドウ・フィトクロムAのアミノ酸配列上の機能ドメイン配置。アミノ末端側の光センサーモジュールは、PAS、GAF、PHYと呼ばれるの三つのドメインから構成され、光受容のためのフィトクロモビリン(PΦB)はGAFドメインに共有結合している。カルボキシ末端側の出力モジュールは、二つのPASドメインとリン酸化酵素ドメイン(HKRD)で構成される。HKRDには核移行配列が存在する。
B: フィトクロムAは、赤色光吸収型(Pr)と遠赤色光吸収型(Pfr)を光可逆的に変換できる。また、Pfr型は暗中でPr型に熱緩和する。Pr型とPfr型の吸収スペクトルには重なりがあるため、赤色光照射下のフィトクロム溶液中では、Pr型とPfr型が混合した光平衡状態となっている。
研究手法と成果
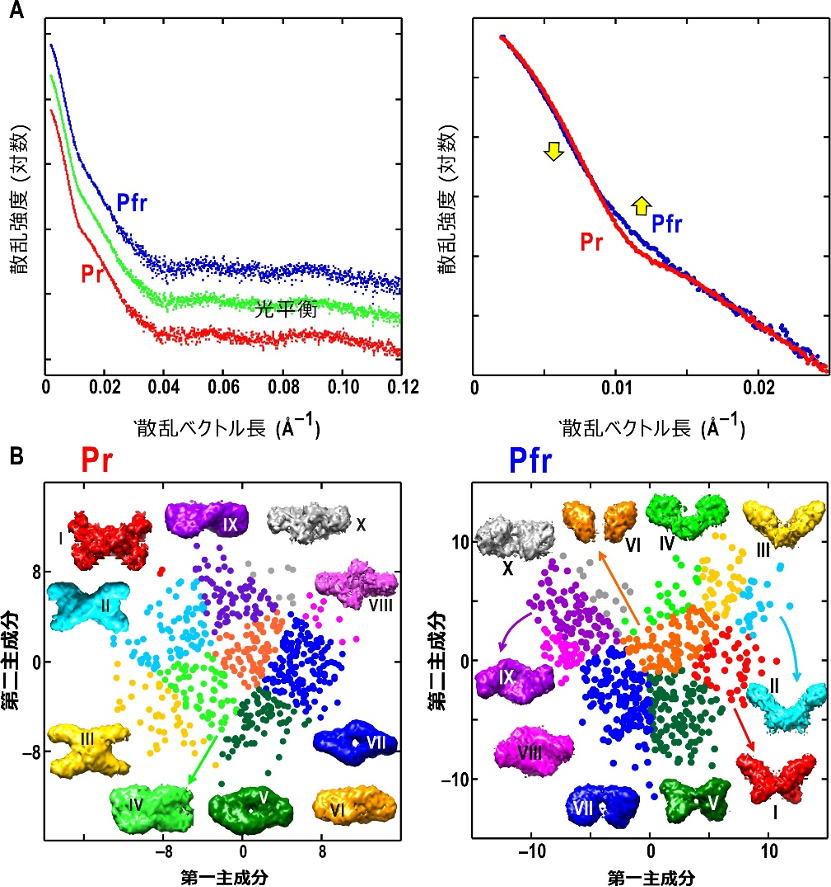
X線小角散乱法では、高純度に精製したタンパク質溶液にX線を照射し、得られる散乱パターンからタンパク質の低分解能構造を推定できます。本研究では、既に大型放射光施設「SPring-8」のBL40B2で取得していた散乱データを再解析しました。フィトクロムA のPr型のX線散乱データは暗中で記録できるのに対し、赤色光照射下ではPr型とPfr型が混在するため、Pfr型のX線散乱データを直接記録できません。そのため、図1Bの吸収スペクトルから、赤色光照射下でのPr型とPfr型の存在比を算出し、それによってPfr型の散乱データを得ました。その結果、Pr型とPfr型の散乱データには強度変化があることから、分子全体に及ぶ構造変化が示唆されました(図2A)。
小角散乱データに非経験的分子形状予測アルゴリズム[10]を適用すると、分子の構造を推定することができます。しかし、このアルゴリズムからはさまざまな分子形状が提示されて、どれが正しい構造なのかを判別できません。この状況を改善するべく、研究チームは多変量解析を用いて構造を分類する法を提案していました注1)。また、研究チームによる最近の研究から、アミノ酸配列の相同性がフィトクロムAと70%以上である類縁タンパク質フィトクロムBがX字型の構造を持つことが明らかになっており注2)、この類縁タンパク質構造を参照することができました。
得られたPr型、Pfr型の各X線散乱データについて、スーパーコンピュータを用いて得られた500個以上の推定分子モデルを10グループに分類し(図2B)、その中から、フィトクロムBと類似するPr型とPfr型の構造モデルを見いだしました。
図2 フィトクロムAのX線小角散乱プロファイルと推定構造の選択
A: (左)Pr型、光平衡状態でのX線散乱データと、吸収スペクトルを用いて算出されたPfr型のX線散乱データ。(右)Pr型とPfr型で散乱強度に大きな差が生じていた。
B: X線小角散乱データに非経験的構造推定アルゴリズムを適用して得た構造にはさまざまな形状が提示された。これを多変量解析に基づく構造分類法を適用し、類縁タンパク質であるフィトクロムBと類似した形状モデルを選ぶことができた。Pr型ではグループII(左)、Pfr型ではグループI(右)のモデルが選択された。
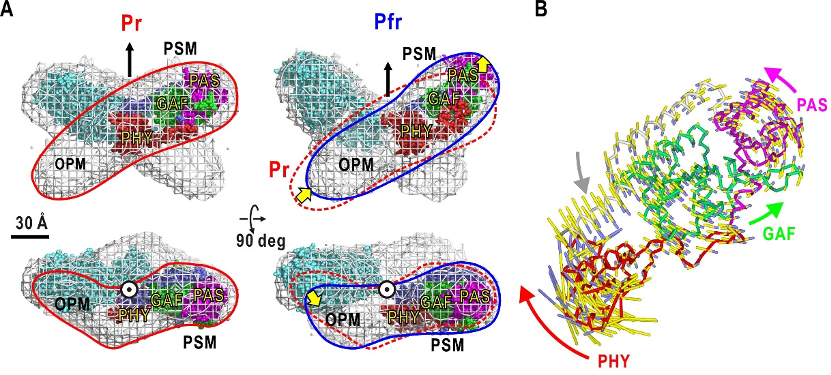
その結果、図3Aに示すようにフィトクロムAは二量体であり、Pr型は中迫雅由客員主管研究員が30年前に提案していた「四つ葉」モデルを再現しました。各単量体は「たらこ」形状をしており、それらが中心付近でX字状に重なることで四つ葉に見えます。Pfr型は、四つ葉より非対称性が高い「蝶」の形をした構造でした。各単量体は、少し変形しながら重なる位置がPr型からずれるため、蝶の形に見えます。これらの構造モデルは、バクテリアが持つバクテリオフィトクロムとは大きく構造が異なるため、それらから得られた単量体の配置などに関する構造知見をそのまま高等植物のフィトクロムに適用することは困難であることも判明しました。
Pr型、Pfr型それぞれの構造モデルで、フィトクロムBの光センサーモジュールの部分構造を当てはめ、出力モジュールとの位置関係を推定した結果、Pr型とPfr型で二つのモジュールの配置が大きく異なることが分かりました。したがって、赤色光照射で励起された光センサーモジュールでの構造変化が、出力モジュールに増幅されて伝達される可能性が示されました。この構造変化の原因を探るために、フィトクロムBの光センサーモジュールについて基準振動解析を行ったところ、PAS-GAFドメインの塊に対してPHYドメインが大きく回転する内在性運動が存在することが明らかになりました(図3B)。このことから、赤色光照射で励起された光センサーモジュールでは、PHYの内在性運動が増幅されて、出力モジュールに伝達され、核移行に必要な他のタンパク質との相互作用が実現されると考えられます。
図3 可視化されたPr型とPfr型の構造モデルと光センサーモジュールに内在した運動
A: フィトクロムA二量体の推定されたPr型とPfr型の構造モデル。赤線、青線は単量体を示す。単量体分子形状の半分の領域は、類縁タンパク質フィトクロムBの光センサーモジュール(PSM)の形状と似ているため、そのモジュールを配置できた。Pr型は四つ葉型であるのに対して、Pfr型では蝶のような構造に変化(黄色矢印)しており、光センサーモジュールが分子中心から移動するとともに、出力モジュール(OPM)も折れ曲がりながら移動していると推定された。
B: 類縁タンパク質であるフィトクロムBの光センサーモジュールの立体構造に対する基準振動解析の結果。PAS-GAFドメインに対して、PHYドメインが回転する運動性が内在しており、赤色光によってPHYドメインが動くことで出力モジュールが構造変化する可能性が示された。
注1)Oide, M., Sekiguchi, Y., Fukuda, A., Okajima, K., Oroguchi, T. & Nakasako, M. (2018) Classification of ab initio models of proteins restored from small-angle X-ray scattering. Journal of Synchrotron Radiation 25, 1379-1388.
注2) Oide, M., Hikima, T., Oroguchi, T., Kato, T., Yamaguchi, Y., Yoshihara, S., Yamamoto, M., Nakasako, M. & Okajima, K. (2020) Molecular shape under far-red light and red light-induced association of Arabidopsis phytochrome B.The FEBS Journal 287,1612-1625.
今後の期待
研究グループはこれまでに、光形態形成に関わるフィトクロムやフォトトロピンの構造をX線小角散乱を用いて調べてきました。いずれのタンパク質も結晶化が難しいため、今後、分子の全体構造や分子内部運動を原子レベルで明らかにするためには、電子顕微鏡[11]による分子の構造多型を考慮した単粒子解析と、室温下で容易に環境を変化させて測定できる放射光X線小角散乱がその鍵になると考えられます。
光受容タンパク質は、光を利用して細胞を制御する光遺伝学に利用され始めています。フィトクロムにおいて光刺激をリン酸化に変換する分子内部機構が解明できれば、デザインされた光遺伝学の展開が可能になると期待できます。
補足説明
[1] 光形態形成
植物が、光に応答して、生長や分化などの形態を制御する現象。高等植物では、赤色/遠赤色光受容体フィトクロムによる発芽、青色光受容体フォトトロピンによる光屈性の制御などがある。
[2] 色素タンパク質
タンパク質は、通常20種類のアミノ酸が結合して形成されるが、そこに光を吸収することができる小分子が結合することで、さまざまな光を吸収し、光エネルギーをイオン輸送や生体内信号伝達に利用することができるようになる。このようなタンパク質を色素タンパク質という。
[3] X線小角散乱法
X線を物質に照射して、散乱するX線のうち散乱角が小さいものを測定することで物質の構造情報を得る手法。タンパク質や核酸などの生体高分子、微粒子や液晶、合金の内部構造といった数ナノメートル(nm、1nmは10億分の1m)での構造解析に用いる。例えば、超臨界流体のような系では、粗密な領域からなる不均一構造(密度ゆらぎ)や密度ゆらぎの相関距離といった構造パラメータにより、その中・長距離構造を定量的に評価できる。
[4] リン酸化酵素
キナーゼとも呼ばれ、アデノシン三リン酸などのリン酸結合を持つ分子からリン酸基を、基質分子あるいは他のタンパク質分子に転移する酵素であり、細胞内での化学信号伝達に広く関わっている。
[5] 大型放射光施設「SPring-8」
理研が所有する、兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する強力な電磁波のこと。SPring-8では、この放射光を用いて、基礎科学からリチウムイオン電池や製薬などの産業利用まで幅広い研究が行われている。
[6] 多変量解析
複数の独立変数からなる多変量データの特徴を抽出分析する計算手法。本研究では、全体のばらつきを最もよく表す主成分変数を見いだす主成分分析によって、構造モデルの記述を低次元空間に落とし込み、その特徴を解析するとともに、K平均化分類法によってモデルを分類する。
[7] 基準振動解析
タンパク質など多数の原子団で構成された分子のゆらぎを調和振動の重ね合わせとして表わす方法。本研究では、タンパク質を構成する各アミノ酸を一つの質点と見なす弾性ネットワークモデルを用いて、基準振動解析を行っている。
[8] フォトトロピン
1880年にチャールズ・ダーウィンらは、光の方向に植物の茎などが屈曲する「光屈性」という、植物における光合成効率を最適にする運動を発見した。1997年に、その光屈性の原因タンパク質として、青色光制御リン酸化酵素タンパク質フォトトロピンが同定された。現在、フォトトロピンが青色光受容信号という物理刺激をリン酸化という生体内信号に変換するメカニズムの解明が、大きな課題となっている。
[9] 避陰反応
植物は、陰に入ると光合成を行う上で不利になるため、茎伸長促進や葉の展開の抑制などによってそのような状況から脱する。この反応は、主に、フィトクロムBによって制御されている。
[10] 非経験的構造推定アルゴリズム
タンパク質のX線小角散乱データから、タンパク質内のアミノ酸残基充填様式で制限を加えながら、焼きなまし法によって散乱データを満足し、かつ、アミノ酸残基の空間充填様式を満足するの形状を予測するアルゴリズム。ただし、必ずしも正しい形状を提示できるわけではない。
[11] 電子顕微鏡
通常の光学顕微鏡では可視光を試料に当てて観察するのに対し、電子顕微鏡では電子線を当てて観察する。電子線の波長は可視光よりもはるかに短いため、理論上0.1 nm程度の分解能が得られる。
問い合わせ先 |
- 現在の記事
- 植物フィトクロムAの構造変化を可視化 -植物光形態形成における分子機構の一端を解明-(プレスリリース)
 phys.keio.ac.jp(中迫)
phys.keio.ac.jp(中迫)