染色体のフラクタルな超構造を可視化 -X線自由電子レーザー・回折イメージングによる新たな展開-(プレスリリース)
- 公開日
- 2023年07月07日
- SACLA
2023年7月7日
理化学研究所
|
理化学研究所(理研)放射光科学研究センター生命系放射光利用システム開発チームの中迫雅由客員主管研究員、上江洲奏研修生(研究当時)、山本雅貴チームリーダー、生体機構研究グループの高山裕貴客員研究員らの研究チームは、X線自由電子レーザー(XFEL)施設「SACLA」[1]で得られた多くの出芽酵母[2]細胞核の投影像から核内染色体分布を可視化するとともに、150ナノメートル(nm、1nmは10億分の1メートル)程度のサブ構造がフラクタル[3]性をもって配列し、染色体を形作っていることを見いだしました。 論文情報 |
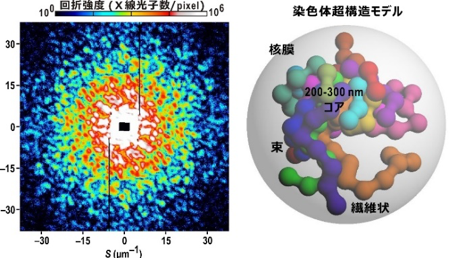
間期出芽酵母核からのX線回折パターン(左)と染色体超構造モデル(右)
背景
生命現象をもたらすマイクロメートル(μm、1μmは100万分の1メートル)サイズの細胞を構成する微小な要素の構造や分布を可視化することは、細胞生物学における大きな目標の一つです。細胞核内に存在する染色体はDNAとヒストンタンパク質から成るヌクレオソーム[8]が基本単位となっており、ヌクレオソーム1個当たり、146塩基対のDNAが巻き付けられています。例えば、染色体に関する研究が多く行われてきた出芽酵母は、細胞核内に16本の染色体を持ち、16本で合計1,200万塩基対のDNAを格納しています。このDNAをつなげて真っすぐに伸ばすと4.1mmになります。酵母細胞核のサイズはおおよそ800ナノメートル(nm、1nmは10億分の1メートル)と小さく、この長大なDNAがどのような仕組みで染色体となって細胞核内に収納されているのかはいまだに不明です。
これまで、細胞核内部での染色体分布のイメージングには、「超解像蛍光顕微鏡[9]」、「透過型電子顕微鏡[10]」、「軟X線顕微鏡[11]」などの手法が用いられてきましたが、それぞれに短所があります。超解像蛍光顕微鏡では、蛍光物質による修飾や励起レーザー光による試料損傷が問題となります。透過型電子顕微鏡では、電子と物質の相互作用の強さに起因して、厚さ100nm以上の試料の場合は内部構造を生のまま観察できず、薬剤固定、重金属による染色、薄片化などを経て試料を作る必要があります。唯一、非侵襲的に(細胞を傷つけずに)細胞を観察できる軟X線顕微鏡では、物質のX線に対する吸収コントラストが観察できますが、DNAと周辺物質を区別するのは困難で、直接物質分布を観察できるわけではありません。
これらの物理学的手法に対し、近年、Chromosome Conformation Capture法[12]という化学的方法を用いて染色体の構造が調べられています。この手法では、ホルムアルデヒド処理(ホルマリン処理)した細胞からDNAを取り出すと、細胞核内で近くに存在していたDNA断片同士がタンパク質を介して結合します。これにより、どのDNA断片が細胞核内で近接していたのかを知ることができ、それを基に計算科学的手法を用いて、大まかな3次元構造モデルを推定します。ところが、ホルムアルデヒド処理によって、生来の染色体構造が本当に保たれていたのか否かが検証されたことはありません。
一方で、X線の透過性を利用し、試料の放射線損傷を大幅に低減できる「低温X線回折イメージング・トモグラフィー法[13]」では、大きな細胞を数十nmの解像度で観察できるようになりました注1)。しかし、1個の細胞の測定に2日間程度を要するため、多数の細胞核の測定には適していません。
注1)2018年10月26日SPring-8プレスリリース「低温X線回折イメージング・トモグラフィー技術の確立」
http://www.spring8.or.jp/ja/news_publications/press_release/2018/181026/
研究手法と成果
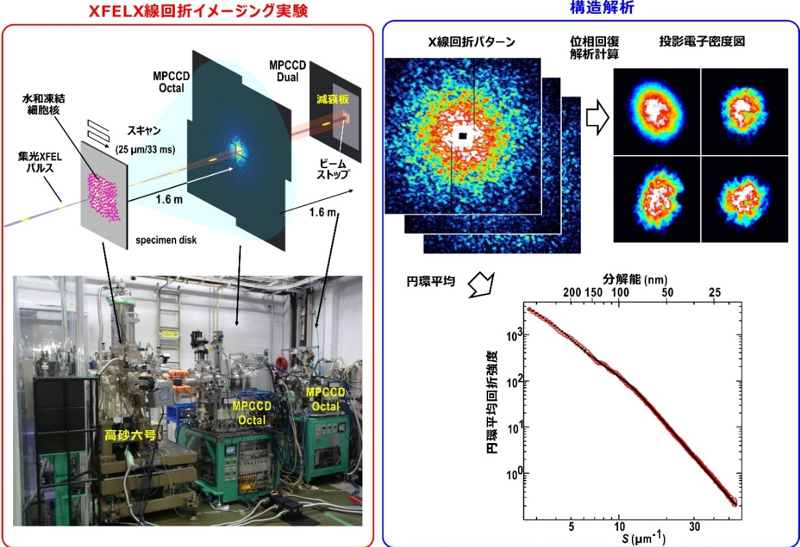
X線回折イメージング法では、非結晶試料粒子に波面のそろった(空間コヒーレンス[14]の高い)X線を照射して回折パターンを取得し、それに位相回復アルゴリズム[15]を用いて、粒子のX線入射方向に対する投影像(投影電子密度図)を取得します。X線自由電子レーザー(XFEL)施設「SACLA」では、30Hzで供給される超高強度のXFELパルスを用いることができます。XFELパルス照射後に試料が原子レベルで壊れるものの、短時間で多数の細胞核のX線回折パターンが得られます。
研究チームは、細胞周期をそろえた細胞や細胞内小器官を試料板に散布・水和凍結し、ほぼ生の状態に保った試料粒子にXFELパルスをもれなく照射することを可能とした低温試料高速照射装置「高砂六号」注2)を開発して、SACLAでのX線回折イメージング実験に用いてきました(図1左)。水和凍結試料は液体窒素温度(−196℃)に保存され、温度上昇や着霜を防ぐ工夫を施したキャリヤーと搬送ロボットによって、装置の真空槽内の高速並進移動ステージに搭載された低温ポット[16]に運ばれます。
間期の細胞から抽出した細胞核を水和凍結して取得した回折パターンからは、位相回復アルゴリズムを用いて、X線パルス入射方向に投影された電子密度が得られます(図1右図上)。さらに、複数の試料から得られた分解能の高い回折パターンの円環平均(X線ビーム位置から等距離の検出器画素強度を平均する操作)を取って足し合わせたプロファイルから、試料内部構造に共通する構造を探ることができます(図1右図下)。
図1 「SACLA」でのX線回折イメージング実験装置と構造解析の概要
(左)低温試料高速照射装置「高砂六号」の真空槽内にある低温ポットに低温凍結試料板を搬送し、高速並進移動ステージを用いて、XFELパルスに対して試料板をスキャンし、回折パターンを収集する。
(右) 2台の検出器で記録した回折パターンを統合後、位相回復アルゴリズムによって投影電子密度を得る。さらに、円環平均によって得られた回折プロファイルから、試料内部構造に共通の構造を探る
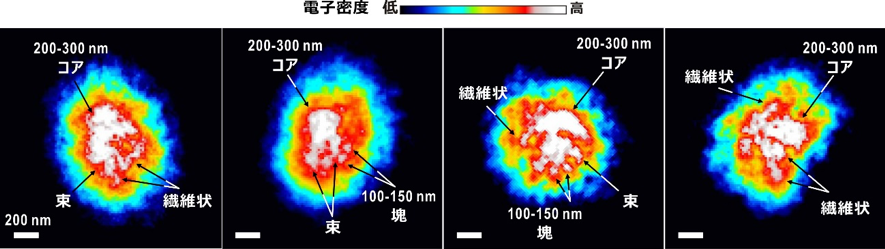
今回、水和凍結された間期酵母細胞核の平均的な形状とサイズを、25nm分解能までの回折パターンから位相回復アルゴリズムによって得た投影電子密度図(図2)から知ることができました。その形状は長楕円体であり、長軸半径435nm、短軸半径360nmで、軟X線顕微鏡で観察された細胞核の形状・サイズとよく一致していました。
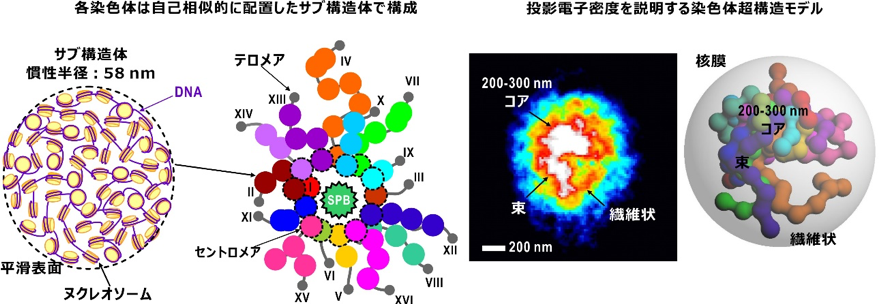
間期酵母細胞核内の電子密度は一様ではなく、図2の投影電子密度図は異なる細胞核からのものですが、特に左端に示したタツノオトシゴ様のコアを持つ図や、右端に示すような図が多く観察されました。これらの投影電子密度図に共通した特徴は、細胞核の中心付近に200~300nmサイズの電子密度の最も高い領域(200−300nmコア)が存在することと、そこから比較的高い電子密度が繊維状に伸びていることです。細胞核の構成要素の中で、染色体が最も高い電子密度を持つことから、コアは16本の染色体の末端領域が集まった領域であり、繊維状や束状の電子密度は、長いDNAで構成された染色体やそれが隣接したものではないかと推察されました。また、100~150nmサイズの塊は、染色体を構成する何らかのサブ構造と考えられました。
図2 典型的な間期酵母細胞核の投影電子密度図
得られたさまざまな投影電子密度図から典型的なものを示す。その形状は、長軸半径435nm、短軸半径360nmの長楕円体であった。中心に電子密度の最も高いコアが存在し、コアから比較的高い電子密度の部分が繊維状に伸びている。左端の図のコアはタツノオトシゴのような形をしており、この図と右端の図のような投影電子密度図が多く観察された。スケールバーは200nm。
投影電子密度図は個々の細胞核の構造的特徴を捉えるのに適していますが、本研究では、さらに、回折パターンを円環平均後に足し合わて回折プロファイルを計算し、間期細胞核内における普遍的な構造の有無を調べました(図1右下)。得られたプロファイルには、何らかの規則的な配列を示唆する回折ピークがなく、染色体内には特別な規則構造が存在しないことが明らかになりました。これまで、薬剤処理で抽出した染色体には30nm周期の構造が存在するといわれてきましたが、この結果はその存在を否定するものでした。
また、プロファイルには特徴的な折れ曲がりがあり、それを境に直線で近似できました。このようなプロファイルは、試料粒子が、自己相似[3]性をもって配置した(質量フラクタル[17]と呼ぶ)サブ構造で構成され、さらに、サブ構造表面に自己相似性(表面フラクタル[17]と呼ぶ)がある場合に観察されるものです。解析の結果、染色体には、最大3,000個のヌクレオソームを収納できる大きさ150nm程度のサブ構造体の存在が示唆されました(図3左)。また、サブ構造体表面の自己相似性の度合いを示す表面フラクタル次元[18]が2.1と求められたので、サブ構造体表面上でヌクレオソームが滑らかに並んでいると予想されます。さらに、プロファイルは、このようなサブ構造体が自己相似的に空間配置していることを示唆しており、解析で得られた、サブ構造体の充填度合いの指標である質量フラクタル次元[18]は2.1となりました。自己相似的配置と投影電子密度図を併せて考えると、サブ構造体が自己相似的なリヒテンベルク図形[3]に似た空間配置を取るモデルが想起されました。(図3左)。
以上の結果に基づくと、出芽酵母細胞核内では、例えば図3右のようなサブ構造配置を考えれば、投影電子密度図を説明できると考えられます。これらの染色体超構造モデルは、DNAが絡まらずに転写や複製されていることを説明できるものです。
図3 染色体内部構造のフラクタル性と予想される染色体超構造
(左)染色体超構造の構成。ヌクレオソームで形成される150nm程度のサブ構造が自己相似的(フラクタル性)に配置して、染色体が形成される。染色体のセントロメア(真ん中にあるくびれた部分)は細胞小器官の中心体(SPB)付近に集まり、リヒテンベルク図形のように伸長し、末端のテロメアは核膜に局在する。
(右)得られたタツノオトシゴ様の投影電子密度図を説明できる染色体の超構造モデル。
注2)2016年5月18日SPring-8プレスリリース
「X線自由電子レーザーによる非結晶試料からの高効率回折データ収集装置を実用化」
http://www.spring8.or.jp/ja/news_publications/press_release/2016/160518/
今後の期待
本研究は、X線回折イメージング実験が細胞核内の染色体超構造を非侵襲で調べるのに適していることを示しました。今後、XFELを用いた実験において、より多数の投影像を収集することができれば、研究グループが以前行ったような解析注3、4)を通じて、3次元で染色体超構造を調べることが可能となります。。また、研究チームは大型放射光施設「SPring-8」において、低温X線回折イメージング・トモグラフィー実験によって分裂期にある酵母細胞1個の3次元イメージングを進めています。この実験では、細胞核を取り出す必要がないので、細胞内でのありのままの核構造を観察できます。しかし、現状2日間程度の収集時間が必要となるため、細胞周期の各段階での構造解析を逐次迅速に実施するには、次期計画のSPring-8-Ⅱや東北大学の次世代放射光施設「ナノテラス」におけるより高輝度のX線が必要となります。
XFELとシンクロトロン放射光を用いたX線回折イメージングの相補的利用が、数十nmの解像度で細胞の個性と多様性の解明につながり、他のイメージング手法では成しえない生物試料の非侵襲的イメージングの進展が期待できます。
注3)2018年7月31日プレスリリース「SACLAにより銅キューブ粒子の内部構造変化を可視化」
https://www.riken.jp/press/2018/20180731_2/
注4)2021年2月19日プレスリリース「シアノバクテリアの普遍的内部構造を可視化」
https://www.riken.jp/press/2021/20210219_1/
補足説明
[1] X線自由電子レーザー(XFEL)施設「SACLA」
理化学研究所と高輝度光科学研究センターが共同で建設した日本で初めてのX線自由電子レーザー(X-ray Free Electron Laser:XFEL)施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLAと命名された。XFELはX線領域におけるレーザーであり、従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とする。XFELはほぼ完全な空間コヒーレント光であり、数フェムト秒(1フェムト秒は1,000兆分の1秒)の超短パルス光である。SACLAでは、2011年6月に最初のX線レーザーを発振、2012年3月から共用運転が開始され、利用実験が行われている。諸外国と比べて数分の1というコンパクトな施設の規模にもかかわらず、0.1nm以下という世界最短波長のレーザーの生成能力を持つ。
[2] 出芽酵母
学名はSaccharomyces cerevisiae。培養操作が簡単で増殖が速いことから、真核細胞のモデル細胞として分子生物学分野で広く使われている。16本の染色体を持つ。全部で1,200万塩基対のDNAには、約6,000の遺伝子が格納されている。
[3] フラクタル、自己相似、リヒテンベルク図形
自己相似とは、図形においてある断片に着目したとき、その断片の形状と図形全体の形状とが相似である場合を指す。フラクタルは、フランスの数学者マンデルブロによる幾何学における概念であり、図形全体と部分が自己相似の関係にある。例えば、海岸線やロマネスコ・ブロッコリー、雷の放電パターンで見られるリヒテンベルク図形(下図)などが身近に見られるフラクタル図形である。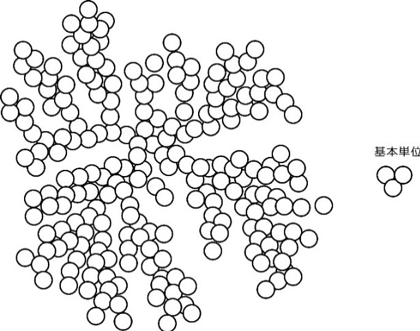
[4] X線回折イメージング
干渉性の優れたX線を試料に照射した際に起こるX線の散乱現象を利用するイメージング手法のこと。
[5] 大型放射光施設「SPring-8」
理研が所有する、兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細くて強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。
[6] 細胞周期
細胞が分裂するサイクル。細胞周期は、間期とM(Mitosis)期に分けられる。間期はG1(Gap1)期、S(Synthesis)期、G2(Gap2)期から成る。M期は母細胞が二つの娘細胞に分裂する期間、間期は次のM期に備え、細胞が成長する期間。S期は特にDNA複製が行われる期間。細胞周期はG1→S→G2→M→G1→…の順に進む。
[7] 低温試料高速照射装置「高砂六号」
SACLAでの低温X線回折イメージング実験のために慶應義塾大学と理化学研究所が共同で開発した回折装置。「たかさごろくごう」と読む。30Hzで供給されるX線自由電子レーザーパルスをもれなく利用するために、高速で試料の並進を行うステージ上に低温ポットを備えており、66~70K(−207~−200℃)の低温で回折実験を行える。低温凍結試料の搬送のために、ロードロック・チャンバーと搬送ロボットを搭載している。
[8] ヌクレオソーム
染色体を構成する基本単位。ヌクレオソームは、4種類のヒストンタンパク質が二つずつ集まって八量体を形成し、146塩基対の2重鎖DNAを左巻きに巻きつけて形成される。ヌクレオソーム構造が集合して染色体を構成するが、その集合形態についてはいまだ定説がない。
[9] 超解像蛍光顕微鏡
光は波としての性質を示し回折現象を起こすため、光学顕微鏡で観察できる空間分解能は回折によって制限され(回折限界)、観察に用いる光の波長の半分程度であることが理論的に示されていた。近年、蛍光分子の特徴を巧みに利用することで、回折限界を超えた高い空間分解能を達成する手法が開発され、これを超解像蛍光顕微鏡法と呼ぶ。
[10] 透過型電子顕微鏡
通常の光学顕微鏡では可視光を試料に当てて観察するのに対し、電子顕微鏡では電子線を当てて観察する。電子線の波長は可視光よりもはるかに短いため、理論上0.1nm程度の分解能が得られ、生体分子やその複合体の構造解析に用いられる。ただし、電子と物質の相互作用が強いことが妨げとなって、厚みのある試料を観察できない。
[11] 軟X線顕微鏡
「水の窓」と呼ばれる波長領域(2.28~4.36nm)のX線と、レンズに相当するゾーンプレートを用いるイメージング手法であり、細胞内物質のX線吸収の違いを可視化できる。
[12] Chromosome Conformation Capture法
大まかな染色体内の構造を捉えるために考案された化学処理と計算科学を組み合わせた実験技術であり、3C法と呼ばれる。この方法を応用して、細胞核内でDNAが3次元的にどのような距離にあるのかを網羅的に得る方法も開発され、Hi-C法と呼ばれている。
[13] 低温X線回折イメージング・トモグラフィー法
トモグラフィーは、回転ステージによってX線入射方向に対する試料の配向を調整し、配向ごとの回折パターンを記録して3次元構造を可視化する手法であり、これとX線回折イメージング法を組み合わせることで、透過型電子顕微鏡では見られない厚みのある非結晶試料粒子の内部構造を可視化できる。水和環境が必須な細胞試料を、−196℃の液体窒素温度程度の低温に冷やすことによって、X線と相互作用した分子が壊れる放射線損傷を低減させることが可能である。
[14] 空間コヒーレンス
ある空間内に複数の光波が存在するとき、波同士の山と山もしくは谷と谷が重なれば、それぞれ山もしくは谷は大きくなる。逆に、山と谷が重なる場合には打ち消される。このような光波の干渉の具合を空間コヒーレンスという。
[15] 位相回復アルゴリズム
回折パターンは、試料で回折されたX線の振幅情報のみを反映したもので、正しい像を再生するためには位相情報が必要になる。位相回復アルゴリズムは、振幅情報から位相情報を取得する手順のこと。
[16] 低温ポット
低温物理学で開発されたデバイスの一つ。液体窒素や液体ヘリウム用貯留槽を内部に持ち、それら冷媒は細管から供給される。貯留槽を負圧(圧力が低い状態)にすることで、蒸発冷却効果が生じ、常圧下の冷媒沸点よりも低い温度に到達できる。振動が生じないので、微小試料へのX線照射が不可欠なX線回折イメージングに適している。
[17] 質量フラクタル、表面フラクタル
物体の表面形状が自己相似性を示すとき、表面フラクタルがあるといい、表面の粗さを評価できる。撥水性表面を作るために、表面フラクタルを利用する場合がある。物体内の物質充填に自己相似性があるとき、質量フラクタルがあるといい、物体の空間的な広がりと、そこに含まれる自己相似配置された物質質量の割合を評価できる。このような二つの自己相似性を有する微小な物体にX線を照射すると、図1右下のように、回折プロファイルが、それぞれのフラクタル次元に依存して変化する。
[18] 表面フラクタル次元、質量フラクタル次元
階層性のある物質に対するX線回折プロファイルでは、回折角の小さな領域において、物質構成要素の分布を反映した質量フラクタル次元に由来した強度変化が観測される。質量フラクタル次元は、1から3の間の実数値を取り、1に近いほど物質の質量分布が線状に近いか、あるいは三次元的な分布でも空隙が多い。一方、3に近いほど三次元分布での質量分布が密になる。回折角の大きな領域においては、物質構成要素の表面粗さを反映した表面フラクタル次元が支配的になる。表面フラクタル次元は2から3の間の実数値を取り、滑らかな表面構造は表面フラクタル次元2を与える。
研究チーム
| 理化学研究所 放射光科学研究センター | ||||||
| 利用システム開発研究部門 生物系ビームライン基盤グループ | ||||||
| 生命系放射光利用システム開発チーム | ||||||
| 客員主管研究員 | 中迫雅由 | (ナカサコ・マサヨシ) | ||||
| 研修生(研究当時) | 上江洲 奏 | (ウエズ・ソウ) | ||||
| 研修生(研究当時) | 山本隆寛 | (ヤマモト・タカヒロ) | ||||
| 研修生(研究当時) | 大出真央 | (オオイデ・マオ) | ||||
| 客員研究員(研究当時) | 岡島公司 | (オカジマ・コウジ) | ||||
| 基礎科学特別研究員(研究当時) | 小林 周 | (コバヤシ・アマネ) | ||||
| チームリーダー | 山本雅貴 | (ヤマモト・マサキ) | ||||
研究支援
本研究は、文部科学省X線自由電子レーザー施設重点戦略課題推進事業「SACLAにおける低温X線回折イメージング実験の展開と標準化(研究代表者:中迫雅由)」、および、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「コヒーレントX線回折による酵母核内の核酸分布イメージング(研究代表者:中迫雅由)」の助成を受けて実施されました。
発表者・機関窓口 |
- 現在の記事
- 染色体のフラクタルな超構造を可視化 -X線自由電子レーザー・回折イメージングによる新たな展開-(プレスリリース)
 ml.riken.jp
ml.riken.jp