タンパク質X線結晶構造解析

SPring-8放射光X線が明らかにするタンパク質立体構造。21世紀生命科学への幕開け!
脳神経中で記憶を運ぶ“物質”
糖尿病に関わるインシュリンの働きを活性化する“物質”
ネズミにアルツハイマー病を発症させてしまう“物質”
の発見やその働きの実験的証明や、細胞膜に埋まって細胞の働きを調整する膜タンパク質の複雑な分子構造の解明など、これまで解析することがたいへん難しいと考えられてきた、私たちの命にとってとても大切な働きをする、タンパク質の本当の姿や働きなどが、最近次々に明らかになっています。
タンパク質の立体構造と機能
タンパク質分子は、それぞれの遺伝子の情報にしたがってリボソームという細胞の中の工場で、20種類のアミノ酸が、短いもので数十残基、長いものでは2万残基以上が、バラエティに富んだいろいろな並び方で“数珠”のようにつなげられて創られます。※プラスワン講座参照(以下プラスワン参照)
それぞれのタンパク質は、精緻にさだまった三次元的なかたちに折りたたまれてはじめて、その固有の機能を発揮できます。ですから、遺伝子によって決まるアミノ酸の配列(一次構造)※プラスワン参照 だけでは、タンパク質の「働き」(機能)を知ることはできないのです。
多くの場合、大きなタンパク質分子のごく一部分がそのタンパク質がつかさどる生体機能の中心的役割をもって働いており、“活性部位”と呼ばれています。一次構造の“ひも”の上では遠く離れた位置にあるいくつかのアミノ酸残基が、ひもが折れたたまれて初めてごく近くに集まり、活性部位を形成するのです。これが、それぞれのタンパク質独自の生理的機能を一次構造だけではなかなか理解することができない理由なのです。タンパク質機能を正確に理解するには、立体構造を、それも原子レベルでの三次元構造を、実際に“目で見て知る”ことが必要なのです。
それにはX線結晶構造解析法が、最も強力な手段です。
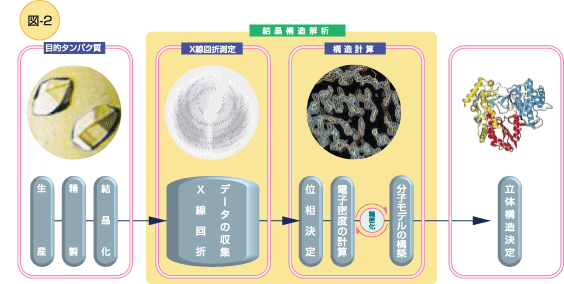
タンパク質X線結晶構造解析のステップ
X線結晶学によるタンパク質の立体構造を解明するには、X線を強く回折する、乱れのない結晶がなにより必要であり、右の図2に示すように、いくつかのかなり困難な段階を経て、進められます。
重要なタンパク質、それがたとえ生体内で極微少量しか存在しない場合でも、また細胞内で必要なほんのわずかな間だけ創られるのでも、結晶構造解析に必要な量のタンパク質試料が、ゲノム科学と分子生物学の急速な進歩により、それぞれの遺伝子を取出し、遺伝子組換えの手法を適用することにより、いまでは容易に入手できるようになっています。
目的とするタンパク質を大腸菌などでつくらせ、精製したのち、タンパク質の結晶作りが試みられます。一般にタンパク質のよい結晶作りには、時間と労力と経験・センスが必要とされます。
(国際宇宙ステーションの日本実験棟(JEM)でよい結晶を作る計画が進められています)
重さの半分あるいはそれ以上を占められるほど多量の水を含んだままのタンパク質の結晶は、乱れのない結晶として結晶化することがとても難しい。うまく結晶化の条件が見つかっても、結晶が成長して構造解析に適した大きさ(現在は0.1mm程度)になるのに、何ヶ月もかかる場合もあります。その上、結晶ができても、たくさんの水を含んだ結晶なので、温度の変化や衝撃に弱くすぐ壊れてしまうものも多く、取り扱いには経験が要ります。
よい結晶が得られると、いよいよX線回折測定段階に入ることになります。規則正しく並んだ多数の同一分子がつくる反復構造(結晶)にX線を照射し、この反復構造によって回折したX線像がつくる膨大な数の回折点を測定します。
回折データがひとそろい得られると、コンピュータを駆使して解析計算を始めます。位相が決まると、電子密度図を描くことができます。※プラスワン参照 分子モデルを構築し、立体構造を決定するには、研究者の経験に基づいた高度な技術が不可欠です。
位相がほぼ正しく決まった電子密度のかたちは、そこに存在する分子の形を反映します。
高度なコンピュータグラフィクス上で分子モデルを構築し、いよいよタンパク質分子が“目”で見られます。
タンパク質の立体構造が決定される瞬間!!です。
| ※宮野 雅司 日本結晶学会誌 42号 P322(2000) |
SPring-8のタンパク質構造解析ビームライン
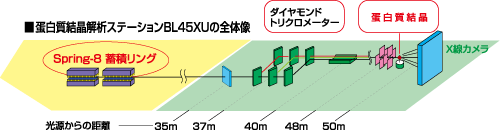
タンパク質は、時に分子量が数100万にもおよぶ巨大な分子です。その結晶からのX線回折は極めて弱いうえに、その構造を決めるために測定しなくてはならない回折点の数は非常に多くなります。微弱で多数の回折点を分解能よく測定しなければならないタンパク質は、結晶化もたいへん困難で、結晶ができても大きさが10から100ミクロンの小さなものが多いのです。このようなタンパク質の結晶構造解析には、輝度が極めて高く、しかも波長を容易に変えることができるSPring-8のX線ビームが、ほかでは得られない優れた光源です。
“高輝度光源”は、微小サイズの結晶でもシャープに回折し、測定できる回折点の数も多くなります。測定データのシャープさ、数の多さは解析を容易にし、決定した構造の正確さと精度を高めます。波長が変えられると、多波長異常分散(MAD)法という方法により、たった一つの結晶だけで構造決定に必要なすべてのデータを測定できます。高輝度で波長可変のSPring-8は、タンパク質の解析には最適です。
SPring-8では現在、データの測定・記録、読み出しなどデータ測定の殆どのプロセスが簡単な操作で出来るようになったBL40B2や、非常に小さな結晶の解析を得意とするBL41XUビームラインをはじめ、理研の構造生物研究ビームライン、BL44B2と、MAD専用BL45XUなど、特徴ある数種のビームラインが稼働しています。各ビームラインにおいて数多くのタンパク質構造解析研究が進められています。
| ※神谷 信夫 サイアス Apr , P16(1999) |
様々なタンパク質の立体構造が明らかにされ、構造から機能を理解することが加速度的に進むと、わたしたちの生活にとても大きな恩恵がもたらされます。
二十一世紀は、タンパク質の形を思い描きながら、生命現像を考えたり病気を治療したりする、時代です。
今、このSPring-8が、重要なタンパク質の結晶構造研究を飛躍的に進展させる力になると大きな期待が寄せられています。
C型肝炎ウイルスに関する酵素の立体構造の解明
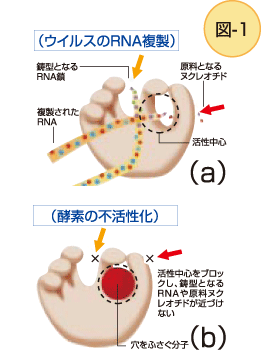
表紙の分子構造図(注1) は、C型肝炎ウィルス(HCV)が増殖するとき自分自身の遺伝子であるRNAを複製するRNAポリメラーゼという酵素の立体構造です。最近SPring-8のトリクロメーター・ビームラインでのMAD(マッド)法※プラスワン参照 も利用し、決定されました。
このポリメラーゼは、10数個のαヘリックスとβシートが組合わさり、ちょうど野球のグローブのような構造をしています。グローブの手のひら部分の、親指とその他の指との間に張られたネットに相当する部分とその下部にあいている穴の奥に、RNA合成機能を発揮する活性部位があります。酵素は、この穴から複製の原料になるヌクレオチドを取り込み、親指と他の指でつかんだHCVウィルスの鋳型RNAの配列に従って、新しいRNA鎖を複製し、伸長させる。この結晶構造を使ってはじめて、酵素が実際に働く様子を描くことができました。(図1a)
C型ウィルスによる肝炎は、慢性肝疾患の90%を占める感染症であり、長年のうちに肝硬変や肝臓ガンにいたる確率が一番高い病気です。今回明らかになった活性部位の穴にきっちりと入り込んで、酵素がRNAを合成できなくする分子を見つけることができれば(図1b)、この分子は、ワクチン生産不可能なC型肝炎を抑える、画期的な薬となるのです。
注1:混みいったタンパク質の分子構造を、αヘリックスはラセン状リボン、βシートは板状の幅広リボンで単純化し、全体の形を支配する二次構造を強調して表すリボン式模式図。
| Further Reading:さらに興味をお持ちの方に役立つ読み物情報を各記事の末尾に※印を示しています。 |