SPring-8が見つける不飽和脂肪酸の有用性 -パセリ油成分が黄色ブドウ球菌の毒性を抑える-
SPring-8が見つける不飽和脂肪酸の有用性
パセリ油成分が黄色ブドウ球菌の毒性を抑える
薬剤耐性菌に対抗する新薬を探す
黄色ブドウ球菌は、人間の皮膚や鼻の中によく見られる細菌の一種です。ブドウの房のように集まった形をしているため、「ブドウ球菌」という名前がついています。この細菌は、普段は特に害を及ぼしませんが、抵抗力の弱い病人や子ども、高齢者などに感染すると重い病気を引き起こしたり、食品中で大量に増殖すると食中毒を起こしたりすることがあります。多くの細菌は「抗生物質」と呼ばれる薬で殺すことができますが、治療を続けるうちに抗生物質が効かない「耐性菌」が出現することがあります。メチシリン耐性黄色ブドウ球菌(Methicillin-resistant Staphylococcus aureus : MRSA)は、代表的な耐性菌のひとつです。MRSA感染症になると腸炎、敗血症、肺炎などを引き起こしますが、複数の抗生物質に耐性を示すため治療が難しく、医療の現場で大きな問題となっています。
MRSA感染症の健康被害を減らすには、効かない抗生物質とは異なるメカニズムでMRSAの毒性を防ぐ新たな薬の開発が必要です。京都工芸繊維大学の北所健悟さんは、分子の形や原子同士の結合の様子をX線で解明する「X線構造解析」の手法を用いて、MRSAに対抗できる薬を研究しています。特に黄色ブドウ球菌の脂肪分解酵素(Staphylococcus aureus Lipase:SAL)が毒性に関わることから、SALの活性を阻害する薬剤を探しています。
「SALを阻害すると黄色ブドウ球菌の増殖も阻害されることが、これまでの研究からわかっています。なぜそうなるのかは解明されていませんが、体を守る免疫細胞の働きに脂肪成分が必要なため、黄色ブドウ球菌がSALを使うことで免疫細胞に抵抗しているのではないかと考えています」
黄色ブドウ球菌の毒性を防ぐ不飽和脂肪酸
北所さんたちの研究グループは、ドラッグデザイン(既に知られている化合物と必要な薬理作用の関係からAIも用いて可能性の高い候補化合物を見つけ出す方法)を駆使して、SALを阻害しそうな候補化合物を100種類以上選び出し、その中で入手可能な化合物とSALの結晶を作成しました。
「そもそも結晶にならない化合物も多いのですが、結晶ができたからといってそこがゴールではありません。本当に原子同士が結合しているかどうかは、X線構造解析を行ってみるまでわからないからです。微妙な差異を見るためには、より高い解像度での解析が必要なため、何度もSPring-8へ通って測定を行いました」
2020年に北所さんたちは、抗肥満薬である「オルリスタット(2024年4月から日本でも発売。商品名アライ)」がSALに結合し、その働きを強く阻害することを発見しました。SPring-8を使用した解析で結合の様子も詳細に確かめ、オルリスタットがSALを阻害し、黄色ブドウ球菌の毒性も防ぐことを示し、論文で報告しました。
さらに候補物質の探索を続けていたところ、「ペトロセリン酸」がSALと結合し、オルリスタットよりもさらに強くSALの活性を阻害することを発見しました。ペトロセリン酸という名前を聞いたことがある人はほとんどいないと思いますが、実はパセリから抽出されるパセリ油に多く含まれています。私たちもどこかで口にしている成分です。
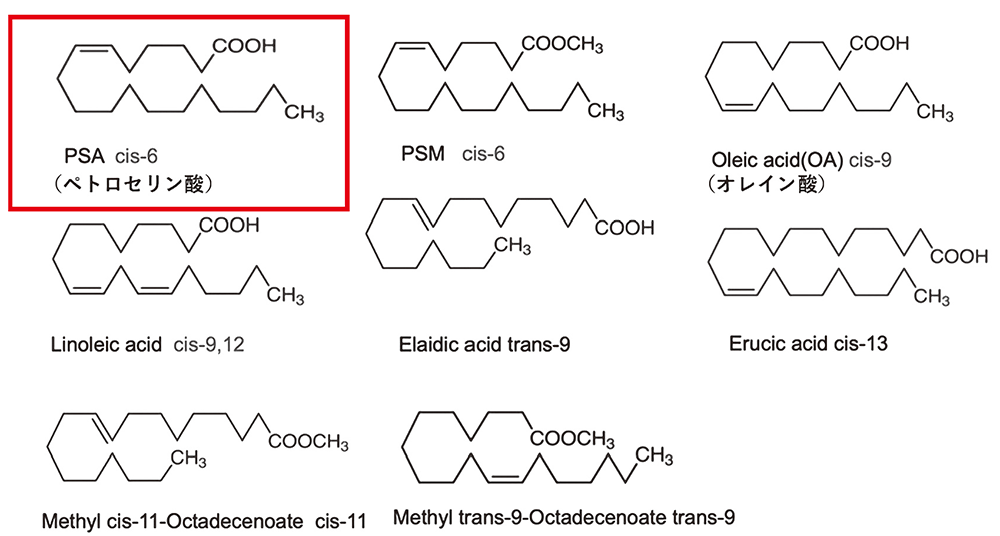
ペトロセリン酸は不飽和脂肪酸と呼ばれるグループの化合物です。不飽和脂肪酸は分子内に二重結合をもつカルボン酸の総称で、この二重結合がヒトの健康に対して良い働きをしていると考えられています。しかし、どのようなメカニズムで健康に良い効果があるのかはわかっていません。北所さんも二重結合に注目して、ペトロセリン酸とSALの結合の様子を詳細に調べました。また、図1に示したペトロセリン酸によく似た構造の不飽和脂肪酸についても共結晶を作って測定を行い、どの構造がSALとの結合に関係しているのかも詳しく検討しました。
図1 北所さんたちが研究で使用した不飽和脂肪酸
SPring-8で結合のプロセスを知る
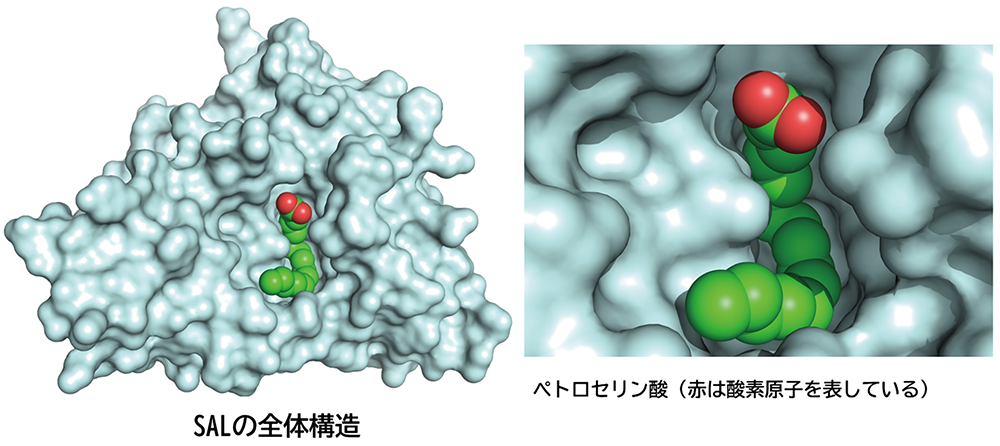
北所さんたちが使ったSPring-8のビームラインは、世界最高レベルの高強度ビームを用いた回折実験ができるタンパク質結晶解析ビームラインBL41XUとBL44XUです。これらによって得られたデータをもとに、SALとペトロセリン酸の結晶の構造を解析した結果をわかりやすく表したものが図2です。
SALは中心にポケットのような穴が開いていて、ここで脂肪を分解することは知られていました。解析結果を見ると、そのポケットにペトロセリン酸がすっぽりとはまっていました。
「模式図としてわかりやすいよう、ペトロセリン酸を色付けしています。たまたま緑と赤を選んだのですが、オープンキャンパスのときにこの図を見た高校生が『はらぺこあおむし』(※)みたいだと言ってくれました。それ以来、あおむしにしか見えなくなってしまいました」
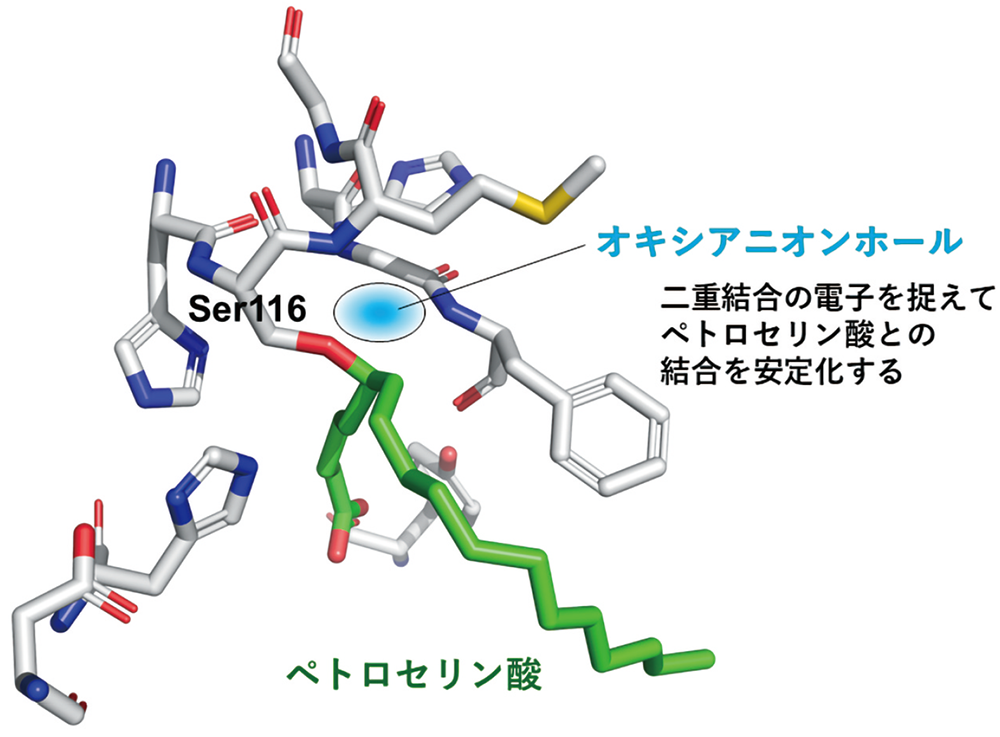
さらに詳しく解析すると、ペトロセリン酸のCOOHがついている側から数えて6番目の炭素原子(C6)とSALの116番目のセリンの酸素原子(O)の距離が 1.43 Åということがわかり、その距離から両者が結合を形成していることが示されました。その隣のC7とOの距離は 2.04 ÅでC6よりも離れており、C7とOは結合していません。
ペトロセリン酸のCOOHをCOOCH3に変えたPSM(図1)では、SALのセリンの酸素原子とC6の結合は起こりませんでした。
「COOHは電子が足りない状態なので、同じ分子内のほかの場所から電子を引き寄せようとします。その影響がC6に及び、結果的に、SALのセリンのOを引き寄せたと考えられます。しかし、COOHをCOOCH3に変えると電子を引き寄せる力は小さくなります。Oを引き寄せる力が弱くなるため、C6とOの結合が起こりにくくなったのでしょう。またTyr29との相互作用がメチル基の導入によって嵩高くなり妨げられた事も要因であると思います」
※『はらぺこあおむし』……アメリカの作家エリック・カートンの絵本のタイトル。日本でも広く読まれている。
図2 解析結果からシミュレートしたSALとペトロセリン酸の結晶の立体構造
ペトロセリン酸の二重結合の位置も重要でした。ほとんど同じ構造で二重結合の位置だけが違うオレイン酸(図1)では、SALとの結合は見られませんでした。これは、セリン酵素がプラス電荷をもった原子によって構成された「オキシアニオンホール」と呼ばれるポケットをもつことが関係していると北所さんは説明します。
図3 SLAのオキシアニオンホールとペトロセリン酸の関係
「オキシアニオンホールは、マイナスの電荷をもつ原子や構造を引きつけます。たとえば、二重結合はマイナスの電荷をもつ構造です。ペトロセリン酸の二重結合はセリン酵素のオキシアニオンホールに近い場所にあったため、マイナス電荷が引きつけられてペトロセリン酸とSALの結合は安定化します。オレイン酸の場合は二重結合の位置が異なるせいで、このホールにはまらないと考えられます。このような詳細な結合状態までわかったのは、SPring-8で得られた高解像の構造解析のおかげですね」
本研究の成果は、今後どのような未来につながっていくのでしょうか。
「SALを阻害するペトロセリン酸のメカニズムが詳細にわかったことで、MRSA感染症の治療薬の開発の有力な手掛かりが得られました。どの原子の結合が重要なのかがわかれば、さらに改良して効果を強めたり副作用を減らしたりすることができます。また、黄色ブドウ球菌が排出する毒素がアトピー性皮膚炎の原因になることが知られていますので、ペトロセリン酸の研究成果を元にアトピー性皮膚炎の治療薬の開発が進む可能性が期待できます。さらに、これはまた黄色ブドウ球菌とは別の話ですが、ペトロセリン酸はヒトの脂肪分解酵素の働きも阻害する可能性が見えてきています。将来的にはペトロセリン酸も抗肥満薬として使えるようになるかもしれません」
パセリの油が感染症を防いだり脂肪の吸収を抑えたりするのであれば、肉料理やお刺身に添えられるパセリは、先人の経験から来る知恵だったのでしょうか。北所さんの研究がさらに進めば、近い将来、パセリの意外な活躍を見ることができそうです。

北所さんが今の研究分野を選んだのは、大学4年生のときに結晶の美しさに魅せられたからだそうです。
「顕微鏡で観察する結晶はどれもすぐに壊れてしまう小さなものでしたが、化合物の組み合わせによってさまざまな色や形があり、非常に美しくて魅了されました」
大学院を出てから企業の研究職に就職した北所さんは、6年間働いた後、アカデミアの世界に戻ってきました。北所さんが大学に戻って研究を始めた1年後の1997年に、SPring-8の供用が開始されました。北所さんとSPring-8の付き合いはその頃から始まり、もう27年になります。
「SPring-8ができる前から、これまでにない強い放射光を使える施設ができるということで大変期待して楽しみにしていました。利用を開始した初期の頃は、放射光が強すぎて今までの測定方法では通用しないことが多く試行錯誤の連続でした。初めてデータが取れたときの感動は、今でもはっきり覚えています」
その2年後、イタリアのジェノバに留学した北所さん。ジェノバの研究所の食堂で出る食事は大変おいしくて、2年で10キロ太ったそうです。写真はワインのブドウ畑で手伝いをしたときのもの。現在の北所さんは「黄色ブドウ球菌の増殖を根こそぎ断つ」と大きな目標を掲げて2024年の科研費を獲得しています。この写真は、未来の決意を予言する貴重な1枚だったのかもしれません。

文:チーム・パスカル 寒竹 泉美
この記事は、京都工芸繊維大学分子科学系 准教授 北所健悟さんにインタビューして構成しました。