生物時計の振動発生に関わるタンパク質の構造とそのメカニズム
理化学研究所 播磨研究所 速度論的結晶学研究チーム
京都大学大学院薬学研究科
加藤 博章
サーカディアン(概日)リズムと生物時計
地球上に生息する多くの生物は、地球の自転により生じる24時間周期の昼夜交代に伴い、体内の様々な活動状態を自律的に変動させています(図1)。この約24時間周期の変動は、サーカディアン(概日:約1日の意味)リズムと呼ばれており、昼夜交代や温度など周囲の環境を一定に保っていても継続する自律的変動です。この周期変動を発振させる細胞内機構が生物時計です。現在までに様々な生物で生物時計の研究が行われ、いくつかの時計遺伝子、時計関連遺伝子が発見されました。そして、時計遺伝子から翻訳されてできたタンパク質がもとの遺伝子の発現を抑えることによって作られるフィードバック制御*によって、サーカディアンリズムが生じていると考えられています。しかし、それらの遺伝子から翻訳されたタンパク質の具体的な働きなど、24時間周期の発振の分子機構は未解明のままです。
機械式の時計では、ゼンマイや振り子、歯車など特徴的な形の部品が決まった順序と位置関係で正しく機能することによって、正確な時を刻むことができます。同様に、生物時計もこうした部品の役割を果たす特徴的な形(立体構造)の時計タンパク質や時計関連タンパク質が、各々の役割を適切な時間に適切な組み合わせで果たすことで、正確な時を刻むものと考えられます。すなわち生物時計は、タンパク質という生体部品によって構成される精巧な分子機械だと考えることができます。したがって、時計タンパク質の形や機能を原子レベルで解明することが、生物時計の分子機構を解明する手掛かりになります。
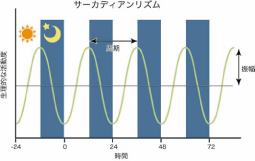
図1 サーカディアンリズムの基本的な性質。
生体内の生理的な活動は約24時間(サーカディアン)周期でリズムを刻むように変動している。変動の大きさを振幅という。
シアノバクテリアの生物時計
シアノバクテリアは、約30億年前に地球上(海洋)に現れた最初の光合成生物であり、大気中の酸素を初めに生成したとされている細菌です。そして、生物時計の存在が知られているもっとも下等な生物でもあります。シアノバクテリアでは、時計遺伝子クラスター*kaiABCが生物時計の遺伝子です。時計遺伝子クラスターkaiABCは2つのオペロン*kaiA及びkaiBCより構成されています。kaiBCオペロンの発現は、時計タンパク質KaiAにより促進され、もう一つの時計タンパク質KaiCにより抑制されます。これが、シアノバクテリアの生物時計におけるフィードバック制御であり、時計の発振の本質であろうと考えられています(図2)。また、KaiCはリン酸化*されることが知られており、リン酸化によって寿命が調節されているようなのです。実は、このKaiCのリン酸化はKaiAによって促進されることが判明しています。そこで、我々は、まず時計タンパク質KaiAの原子レベルでの立体構造を解明して、生物時計装置の働く仕組みを明らかにすることにしました。もちろん、KaiA、KaiB、KaiC、それぞれのタンパク質がどの様な形をしており、時計の発振機能の鍵がどこにあるのかは全く分かっていませんでした。
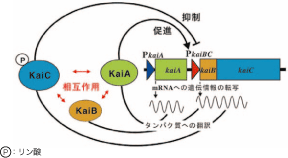
図2 シアノバクテリアの生物時計のフィードバック制御モデルの概念図。
KaiAタンパク質は、KaiBとKaiC遺伝子のプロモータ*PkaiBCを活性化して、mRNAへの転写を促進する。一方、KaiCタンパク質は、PkaiBCを抑制して、自分自身の生産を減らす。これによって、KaiCタンパク質の量的周期変動が生じることになる。また、KaiAは、KaiCに作用してKaiCのリン酸化を促進する。リン酸化は、KaiCの寿命を調節している可能性がある。
KaiAの原子構造と働く仕組みの重要部位
分子生物学的な実験からKaiAは、リズムの振幅を増強するアミノ(N)末端の振幅増幅ドメイン、周期を約24時間に調節する中央部の周期調節ドメイン、時計の発振を司るカルボキシ(C)末端の時計発振ドメインの、3つのドメインから構成されることが明らかになりました(図3)。また、時計の発振そのものに必須な機能は、全てC末端時計発振ドメインに局在していました。そこで立体構造解析の標的を、C末端の時計発振ドメインに絞りました。X線結晶構造解析によりタンパク質の立体構造を決定するためには、タンパク質を高純度に精製し、結晶化する必要があります。そこで、耐熱性が高い別府温泉産の好熱性のシアノバクテリアから得たKaiAのC末端時計発振ドメインを用いて解析を行なったところ、1.8Å(1Å=10-10m)という高い分解能でのX線結晶構造の決定に成功しました。その際、SPring-8の高性能なX線(BL26B1, BL26B2)を用いた多波長異常分散法の利用が解析実現のカギとなりました。全く新規な構造の解析でしたが、データ測定から構造決定までわずか3日で済みました。
KaiAにおけるC末端時計発振ドメインの全体構造は二量体(図4)であり、凹レンズ状の構造でした。凹面のほぼ中央に位置するN末端から270番目のヒスチジン残基は、その側鎖をKaiA分子の外側に突き出しており、何らかの機能を担っていると予想されました(図4)。そこで、このヒスチジン残基をアラニン残基に置換した変異体を作製したところ、変異型KaiAではKaiCとの結合能やKaiCリン酸化促進能が著しく低下し、生物時計は全く発振しなくなりました。この結果より、このヒスチジン残基がKaiAの時計発振機能に必須であることが初めて明らかになりました。
また、KaiAには、現在までに生物時計の周期や振幅に影響を与える多数の変異が報告されています。今回決定した立体構造に基づいてこれらの変異の位置と影響を解析した結果、構造に大きく影響を与える変異は、リズムに大きな影響を与えて周期が無くなったり周期が延びたり、リズム振幅の低下などを引き起こし、構造にあまり影響を与えない変異は、時計の発振自体にはほとんど影響を与えず、わずかに周期が延長されるのみであることが分かりました。

図3 KaiAの3ドメイン構造と機能
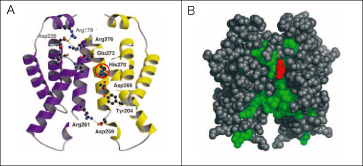
図4 KaiAタンパク質の立体構造。
Aはリボンモデルで描いた図。KaiAは、二量体であり、それぞれのサブユニットを、紫色と黄色で示した。Bは空間充填モデルで描いた図。アミノ酸配列が判明している13種類のシアノバクテリアで保存されているアミノ酸残基は、緑色で示した。ただし、時計発振機能に必須な270番目のヒスチジン(His270)は、赤色で示した。
今後の展開
今回の成果により、KaiAにおけるC末端時計発振ドメインの立体構造と機能との関係を原子レベルで解明することができました。今後、さらに生物時計装置の分子機構について原子レベルでの解明を進めたいと考えています。今回明らかにしたKaiAの立体構造とそれに基づいた解析は、今後の生物時計装置における原子レベルでの研究に新しい方向性を示したといえます。生物時計装置の解明により、生体リズムの不調による不眠症などの治療、薬物の最も効果的な投与時間の解明、植物の発生や成長を制御することによる生産性の向上などが可能になると考えられます。
この成果は、米国の科学雑誌『Nature Structural & Molecular Biology』の2004年7月号に掲載され、月刊最優秀論文(the article of the month)に選ばれました。〈Uzumaki T.,“Crystal structure of the C-terminal clockoscillator domain of the cyanobacterial KaiA protein”, Nat. Struc. Mol. Biol., 11, 623 - 631 (2004)〉
本研究は、主に理化学研究所の中津亨研究員(京都大学大学院薬学研究科助教授)、名古屋大学遺伝子実験施設の宇津巻竜也研究員、石浦正寛教授と共同で行われました。また、名古屋大学の研究は、主に独立行政法人生物系特定産業技術研究支援センターの「新技術・新分野創出のための基礎的研究推進事業(PROBRAIN)」により支援されました。
用語解説
●フィードバック制御
入力と出力のあるシステムで、出力に応じて入力を変化させる制御機構のこと。生体内では、ホルモンなどが過剰に生産されると、その最終的な生産物がその生産過程の最初の反応を抑えるように働く。
●遺伝子クラスター
複数の遺伝子が非常に狭い範囲に並んでいる状態のもの。
●オペロン
遺伝子発現において、同一のプロモータによって発現調節を受けている一連の遺伝子群のこと。多くの場合、同一オペロンに属する遺伝子群は機能的にお互いに関連している。
●プロモータ
DNAの遺伝情報からメッセンジャーRNA(mRNA)への転写開始を制御する遺伝子DNA上の領域。プロモータにRNA合成酵素が結合することで下流に位置するオペロンの転写すなわち鋳型DNAと相補的なmRNAの合成が開始される。
●タンパク質のリン酸化
生体内のタンパク質は、酵素の働きでリン酸化される(リン酸基が付加される)ことにより、その機能や活性が変化するものがある。すなわち、リン酸化の有無によって、非常にたくさんのタンパク質の働きが調節されている。