インフルエンザの新薬を目指して
インフルエンザウイルス
毎年、冬になると流行が心配されるインフルエンザ。その症状は、咳や熱など風邪に似ています。普通の風邪は細菌が原因ですが、インフルエンザはウイルスの感染によって起こります(図1)。
インフルエンザウイルスは、8本のRNAを遺伝子としてもっており、ウイルス粒子の表面には2種類のスパイク状のタンパク質が存在しています。あまりにも単純な構造のために、自己増殖する能力がありません。代わりに、人の細胞に侵入し、そのシステムを巧みに利用して増殖します。
表面にある2種類のスパイク状のタンパク質は、ヘマグルチニン( HA)とノイラミニダーゼ(NA)です。HAは、細胞表面に存在する糖タンパク質に結合します。それによりウイルスは細胞に侵入します(感染という)。一方、NAは、ウイルスが細胞から放出されるときに、ウイルスと細胞を切り離す働きをもっています。この2つのタンパク質を構成しているアミノ酸は変わりやすく(変異という)、HAは16種類、NAは9種類も見つかっています。その組み合わせの数(H1N1〜H16N9)だけインフルエンザウイルスには種類があるのです。例えば、人間に感染するもっとも基本的なウイルスはH1N1。最近、大流行が心配されている鳥インフルエンザウイルスは、H5N1です。種類の違いによって、病原性の強さも異なります。例えば、1918年に大流行したスペインかぜや1968年の香港かぜなどでは、強毒性のインフルエンザが原因で多くの人が亡くなりました(図2)。
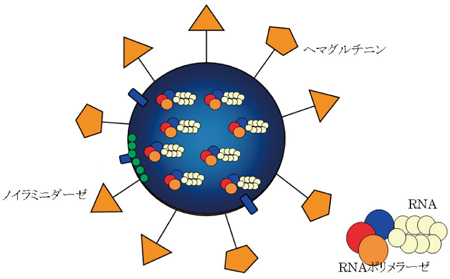 図1. インフルエンザウイルスの模式図表面にスパイク状のタンパク質がたくさんついているのがわかる。
図1. インフルエンザウイルスの模式図表面にスパイク状のタンパク質がたくさんついているのがわかる。ヘマグルチニンは、人の細胞に侵入する際に、ノイラミニダーゼは人の細胞から放出される際に働く。
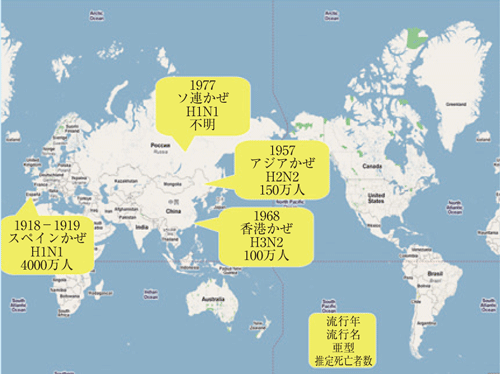 図2. インフルエンザウイルスの大流行の歴史
図2. インフルエンザウイルスの大流行の歴史難しい治療
現在、対処法としてはワクチンによる予防と、タミフルのような抗ウイルス薬による治療があります。ワクチンは、あらかじめ流行するインフルエンザを予想してつくられます。それを投与すると感染しても、免疫反応がすばやく起こるので、ウイルスは増殖できません。しかし、種類の違うインフルエンザウイルスには、効果がないという欠点があります。
タミフルは、ウイルスが感染細胞から放出され感染が広がるのを抑える薬です。放出されるのを食い止めるには、感染後48時間以内に投与しなければ効果がありません。いずれにしても、根本的な治療法はなく、インフルエンザの快復は患者の体力によるところが大きいのです。体力のない子どもや高齢者には怖い疾患です。
「いまだに、患者との接触を避けて、うつらないようにするのが最良の対処方法です」と話すのは、横浜市立大学生命ナノシステム科学研究科生体超分子システム科学専攻の朴三用(ぱくさんよう)准教授。インフルエンザウイルスの増殖にかかわる“酵素”の構造解析に取り組んできました。そして、2008年7月、新薬開発につながる重要な部分の構造を明らかにしました。
まず、敵を知る
どのタンパク質の構造を解析すれば、創薬につながるか?朴准教授はインフルエンザウイルスの増殖のメカニズムに注目すれば、その答えが見えてくると考えました。
インフルエンザウイルスは、人の細胞の中で、自らの遺伝子を複製し、タンパク質を合成します(図3)。こうしてつくられた遺伝子やタンパク質からウイルスが組み立てられ、最後に人の細胞から外へ飛び出します。
このような増殖を行うために、インフルエンザウイルスは自前のタンパク質を10個もっています。その1つにRNAポリメラーゼという酵素があります。これは、ウイルスの遺伝子の複製を行う重要なタンパク質です。このRNAポリメラーゼはPA、PB1、PB2の3つのサブユニットからできています(図4左)。どのサブユニットが欠けても、酵素としての働きは失われ、ウイルスは増殖できません。
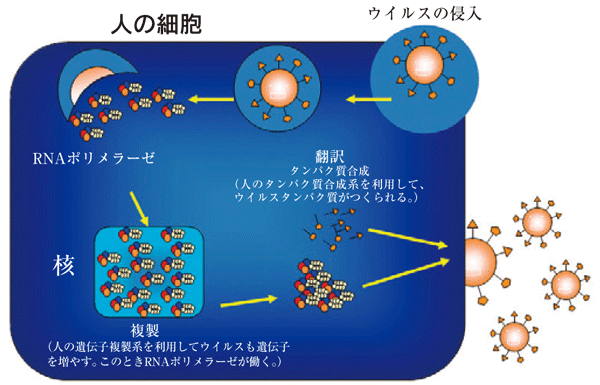 図3. インフルエンザウイルスの増殖機構インフルエンザウイルスは、
図3. インフルエンザウイルスの増殖機構インフルエンザウイルスは、細胞に侵入し、細胞のシステムを利用して遺伝子をふやしたり、タンパク質を合成したりする。
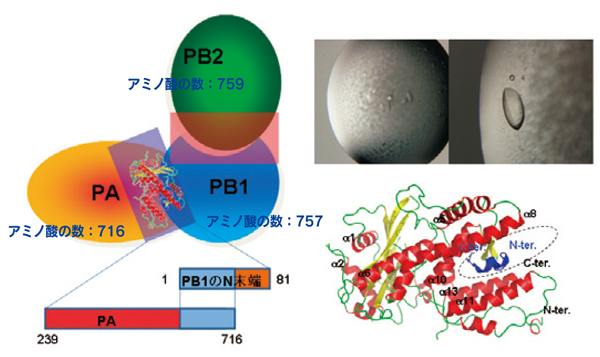
図4. インフルエンザRNAポリメラーゼのサブユニットの構造RNAポリメラーゼのPA、PB1、PB2のサブユニットの模式図(左)。
PA(239-716)とPB(1-81)の複合体の結晶化に成功(右上)。SPring-8のビームラインBL41XUを使った結晶構造解析を行った。その結果、PAのC末端部分の鍵穴のような構造(点線部分)に、PB1のN末端81アミノ酸のうちの15アミノ酸(青)が入り込んでいることがわかった(右下)。
RNAポリメラーゼの構造解析
3つのサブユニットがどのように結合しているか立体構造がわかれば、人為的にサブユニット間の結合を切って、RNAポリメラーゼが働かないようにできるかもしれません。そこで、PAとPB1がどのように結合しているかを調べることにしました。
構造を調べるには、ある程度の量が必要です。ウイルスから大量にとることはできないため、大腸菌につくらせます。これは、タンパク質を大量に必要とする場合に一般的に行われる手法です。しかし、大腸菌はPAとPB1の安定なタンパク質をつくることができませんでした。
今回の目的はPAとPB1の結合部分の構造を知ることです。全体の構造をつくる必要はないと考えた朴准教授は、PAとPB1の長さを短くして結合にかかわる部分だけにしようとしました。しかし、PAとPB1のどの部分が結合しているか明らかになっていなかったため、さまざまな長さのPAとPB1の組み合わせを大腸菌につくらせました。200以上の組み合わせを試した結果、PAのアミノ酸239から716番の部分と、PB1のアミノ酸1から81番部分を組み合わせると安定なタンパク質が得られることがわかりました。
次に、この安定なタンパク質を結晶化させ、X線構造解析を行いました。初めは、他の放射光施設で実験したところ、十分な分解能が得られず、アミノ酸の主鎖の構造を知るのがやっとでした。そこで、SPring-8のビームラインBL41XUの高輝度X線を使って、より詳細な立体構造の解析に取り組みました(図4右)。PAとPB1の結合部位は、鍵と鍵穴の関係のように、PAタンパク質のポケットの部分にPB1タンパク質が差し込まれていました。「これほど大きなタンパク質では、互いに表面で接するように結合しているのが一般的です。一方がもう一方の中に入り込むような形で結合している例は珍しい」と朴准教授は解析結果に驚いたと言います。
さらに、PAの鍵穴に相当する部分のアミノ酸をいろいろ変える実験を行い、PB1との結合に大事なアミノ酸も突き止めました。
新しい薬につなげる
RNAポリメラーゼは、3つのサブユニットがすべてそろっていないと、働きません。サブユニット間の結合を阻害するような物質は、薬として有効だと考えられます。既に、PAとPB1の結合を阻害する物質がいくつか見つかっています。
このRNAポリメラーゼをターゲットに薬をつくる大きな利点はもう1つあります。RNAポリメラーゼは、他のタンパク質と比べ、変異が起こりにくいタンパク質です。つまり、どのインフルエンザウイルスでも共通のアミノ酸配列でできています。その理由を朴准教授は、ウイルスの増殖で中心的に働くタンパク質であるため、そう簡単には変わらないのだろうと考えています。RNAポリメラーゼをターゲットにした薬は、どのインフルエンザウイルスにも有効だということです。
朴准教授は、いろいろなアイデアによっていくつもの課題を乗り越え、PAとPB1の結合部分の構造解析に成功しました。この成果を薬の開発につなげるには、たくさんの候補物質の検討や人体への影響の調査が必要で、これまで以上に人手と費用がかかります。それは、1つの研究室でできることではありません。「他の研究室や製薬会社と連携しながら実用化に向けた研究を進めたいです」と朴准教授。インフルエンザが騒がれない冬は、そう遠くないかもしれません。
コラム:日本に来て20年。いろんな環境を楽しんできました。
「故郷に一番近い留学先でした」と日本の大学を選んだ理由を笑いながら話す朴准教授は、大阪大学に通っていた学部生の頃、週末には韓国・釜山に帰っていました。大阪大学の豊中キャンパスから伊丹空港へは自転車で20分。そこから飛行機に乗って釜山までは約1時間の道のりでした。「いつでも帰れると思っていましたが、日本に来て20年が経ってしまいました」。それは、文化も食べ物も自然に受け入れられたから。
20年の間には、いろいろな場所で研究しました。SPring-8にいた1996年から4年間のことは、近所の自然やスポーツを大いに楽しんで、都会から離れた環境を満喫したと振り返ります。「子供が大きくなった今は、現実的に帰れなくなってしまいました」。どんな話からも、いつも自然体な人柄が伺えました。
 国際会議で訪れたデンマークのオーフスにて
国際会議で訪れたデンマークのオーフスにて取材・文:サイテック・コミュニケーションズ 池田亜希子
この記事は、横浜市立大学生命ナノシステム科学研究科生体超分子システム科学専攻の朴三用准教授にインタビューをして構成しました。