副作用のないがん治療をタンパク質製 ドラックデリバリーシステムで実現する

副作用のないがん治療をタンパク質製 ドラックデリバリーシステムで実現する
日本人の死因の第1位はがんで、3割の人が命を落としています。がんの治療法には外科的手術や放射線治療などがありますが、抗がん剤による治療と併用することが一般的です。しかし抗がん剤は正常な細胞にも作用するため、免疫細胞の減少や吐き気、脱毛が起きたり、薬の種類によっては心臓や腎臓、生殖器などの機能が低下する場合があります。そのような副作用が患者さんの生活の質を大きく損ね、がん治療の大きな障害となっています。
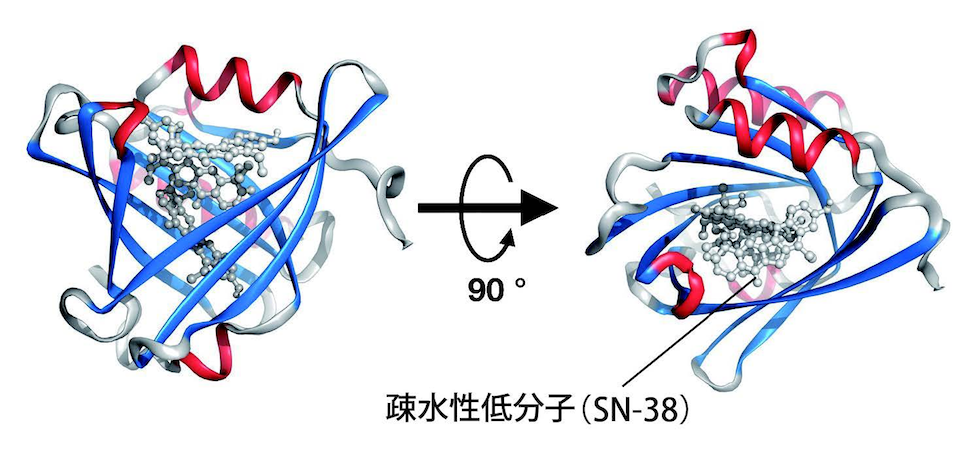
大阪府立大学の乾 隆さんたちは、L-PGDS(リポカリン型プロスタグランジンD合成酵素)という、ヒトの体内で働く輸送タンパク質をドラックデリバリーシステム(DDS:薬物送達システム)として利用し、がん細胞だけに抗がん剤を運んで作用させることで、副作用のない抗がん剤治療を実現することを目指しています(図1)。
乾さんがL-PGDSに出合ったのは、製薬企業で9年間、研究を続けた後、1998年にポスドクとして赴任した大阪バイオサイエンス研究所でした。「そこでは睡眠の研究を行っていて、睡眠誘発作用を持つ物質(PGD2)をつくる酵素としてL-PGDSに注目していました。私はL-PGDSの構造と機能の相関について詳しく知りたいと思いましたが、結晶化が必要なX線結晶構造解析や、NMR(核磁気共鳴)による構造解析は容易ではありません。前年の1997年に供用が開始されたばかりのSPring-8では、X線溶液散乱(X線小角散乱:SAXS)法により、生体に近い溶液中で分子の大まかな形や大きさを測定できると聞き、L-PGDSの解析を行ってみることにしました」と乾さんは振り返ります。
そのSAXS測定で、予想外のことが分かりました。「L-PGDSは脳脊髄液に多く存在するタンパク質で、脳脊髄液中に水に溶けにくい疎水性低分子があると、スカベンジャーとして、それを取り込んで排除する機能を持つと推測されます。分子を取り込むとL-PGDSのサイズは大きくなると予想していました。ところがSAXS測定を何度繰り返しても、サイズが1割ほど小さくなるという結果になりました。L-PGDSは分子を内部に取り込んで“コンパクトパッキング”を行うのです。私はその測定結果などから、L-PGDSは人工的に合成された化合物である薬剤を運ぶDDSとして有望ではないかと思い始めました。ただし、L-PGDSのようなタンパク質をDDSとして利用する研究は、誰もやったことがありませんでした」
水に溶けにくい薬の候補分子を復活させるL-PGDS
2002年に三重短期大学に移った乾さんは、L-PGDSをDDSとして利用する研究を本格的に始め、2005年から大阪府立大学でその研究を続けています。「私は製薬企業での研究経験から、優れた薬効があっても水に溶けにくいために薬にすることを諦めた分子がたくさんあることを知っていました」
水に溶けにくい薬を飲んでも、体の中で塊となり腸から吸収されません。また、水に溶けにくければ注射液に溶かすこともできません。一方、水に溶けやすくなるように化学構造を改変すると、多くの場合、薬効が落ちてしまいます。
「L-PGDSは、サイズや化学構造が異なるさまざまな種類の疎水性低分子を取り込んで、水に溶かすことができます。水に溶けにくいため薬にすることを諦めた多くの分子も、L-PGDS製DDSを使って溶かせば、薬として利用できるはずです」
乾さんたちは、L-PGDSにはDDSとしてさらに有望な特徴があることを実験で確かめました。
既存のDDSとしては、細胞膜をつくる脂質二重膜に似たリポソームや高分子ミセル、毒性をなくしたウイルスや抗体など、さまざまなタイプのものが開発され、実用化されているものもあります。ただし、DDSキャリアーが免疫細胞に異物と認識されて、激しいアレルギー反応を引き起こす可能性があることが、DDS開発の大きな課題の一つとなっています。
乾さんたちは、L-PGDS製DDSをマウスに投与して、アレルギー反応が起きないことを確かめました。L-PGDSはヒト型タンパク質です。それをマウスに投与してもアレルギー反応が起きないのは、なぜでしょうか。「免疫細胞は、タンパク質を構成する特定のアミノ酸配列(エピトープ)を目印にして異物と認識します。L-PGDSにはその目印がないので、マウスでもアレルギー反応が起きないのだと推測しています」
乾さんたちは、脳で働く薬(抗不安薬のジアゼパムなど)を内包したL-PGDSをマウスに注射する実験を行い、可溶化された薬が脳に到達して薬効が現れることも確かめました。脳には、有害な物質が血管から脳へ運ばれないようにする「血液脳関門」という仕組みがあるため、薬を注射しても脳の細胞へ到達できない場合があります。そこで、L-PGDSにその関門を通過できるような工夫を施し、薬を内包したL-PGDSを脳に到達させることを目指した研究も行っています。
L-PGDSは、口から飲む経口投与用DDSとしても優れた効果を発揮します。「L-PGDSは胃では分解されず、腸に届いて分解され(腸溶剤として働く)、放出された水に溶けにくい薬が効率的に吸収されることも確かめました。経口投与用DDSとしては、今すぐにでも実用化できるはずです」
がん細胞だけに薬を届けて作用させる
乾さんたちの最終目標は、L-PGDSを抗がん剤用のDDSにすることです。さまざまなタイプのDDSが抗がん剤用を目指して開発を進めており、実用化されたものもあります。しかし、副作用がほとんど出ない抗がん剤用DDSは実現されていません。それを実現するには、輸送途中で薬を漏らさずにしっかり保持してがん細胞までたどり着き、そこで薬を放出してがん細胞に作用させることが必要です。
乾さんたちは、SN-38という抗がん剤を使って実験を進めています。SN-38も水に溶けにくいため、そのままでは投与できません。そこで、化学構造を改変して水に溶けやすくした薬剤(CPT-11)が、大腸がんや肺がん、卵巣がんなどの治療に使われています。
CPT-11は体内の酵素によってSN-38に変換されてがん細胞に作用します。しかし、その変換効率は投与した量の10 %以下と低いこと、激しい下痢などの副作用が現れることが報告されています。
L-PGDS は、平均3個のSN-38を包み込んで水に溶かすことができます。SPring-8でSAXS測定を行うと、SN-38を取り込んだ場合にもL-PGDSのサイズが小さくなり、コンパクトパッキングが起きることが分かりました。
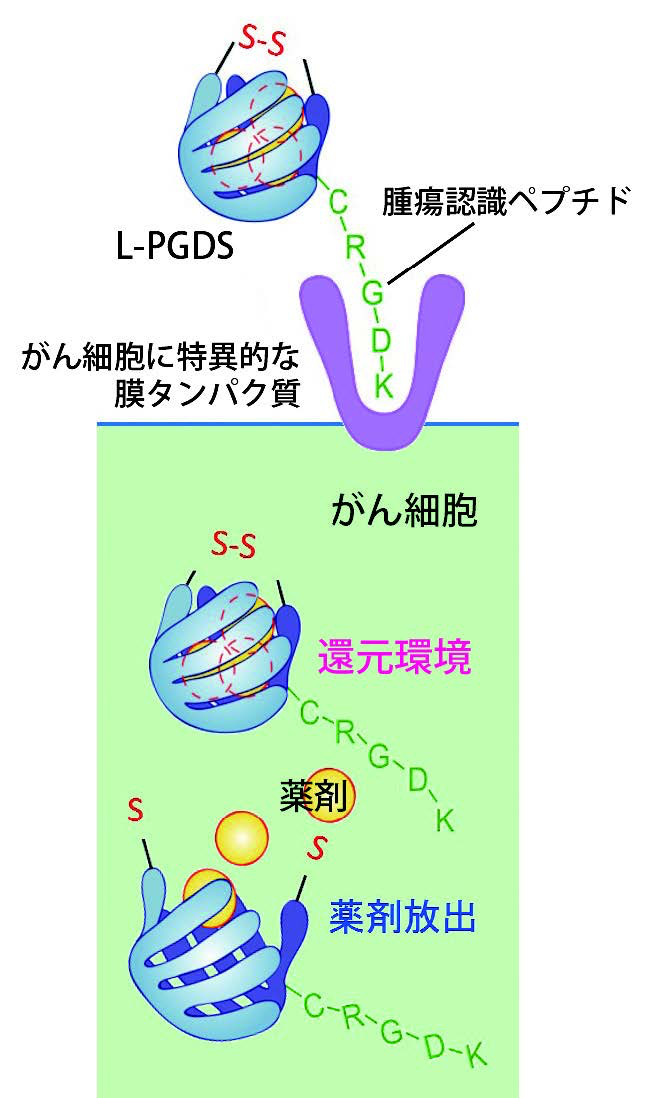
「その現象によりL-PGDSの入り口の幅が狭くなるので、S-S結合(ジスルフィド結合)を導入すれば、酸化反応により入り口を閉じてSN-38がこぼれないようにすることができます(図2)。さらに、がん細胞の表面だけに出ている膜タンパク質を認識して細胞内部に取り込まれるようにする腫瘍認識ペプチドをL-PGDSに付け加えました。がん細胞にL-PGDSが取り込まれると、細胞内の還元的環境により、S-S結合が外れてSN-38が放出され、がん細胞を死滅させます」(図3)
現在の遺伝子組換え技術を使えば、S-S結合や腫瘍認識ペプチド(iRGD や CRGDK)を付加したL-PGDSに改変することは容易です。それもタンパク質製DDSの利点です。改変したL-PGDSを腫瘍があるマウスに投与したところ、L-PGDSは腫瘍に集積することが分かりました。「ただし、がん細胞にたどり着く前にこぼれてしまうSN-38もあることが分かりました。S-S結合で入り口を閉じても、すき間からSN-38が漏れ出てしまうからです」
SPring-8によるSAXS測定や、NMR測定のデータをもとに、コンピュータ上で入り口のどの位置をS-S結合で閉じればSN-38が漏れにくくなるかを検討し、実際にS-S結合を異なる位置に付けたL-PGDSを複数作製し、効果を確かめる実験を乾さんたちは進めています。
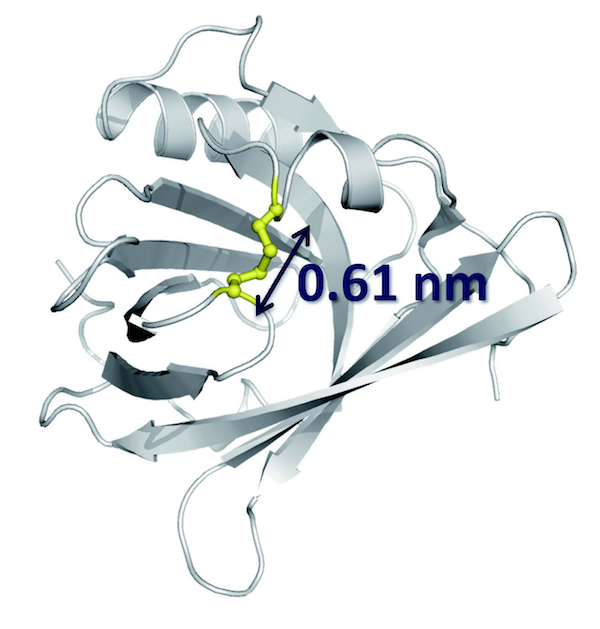
SPring-8のSAXSやNMRの測定により、L-PGDSは低分子を取り込むことで、入り口の幅(矢印)が1.36 nmから0.61 nmに縮まると推測された。それによりS-S結合(黄色)を形成し、入り口を閉じることが可能となる。
「L-PGDSの内側を、しっかりと薬が結合する構造に改変する方法も有効かもしれません。タンパク質の外側を改変すると免疫細胞に異物と認識されてアレルギー反応が起きる可能性がありますが、内側の改変ならばその可能性は低いでしょう」
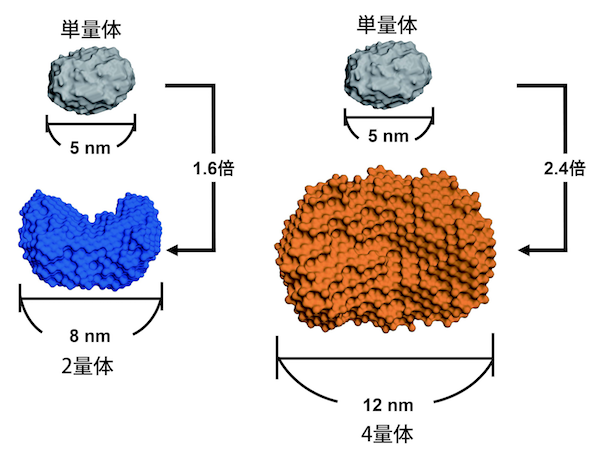
乾さんたちは、EPR効果を利用する方法も検討しています。薬は血管の壁のすき間を通って細胞に作用します。正常な細胞の周りの血管の壁のすき間は約10 nm(1 nm=10億分の1 m)以下ですが、がん腫瘍の周りにできる新生血管の壁には200 nmほどの大きなすき間があります。また、腫瘍組織の付近は異物を排除する機能が弱いため、長時間、薬が腫瘍に留まります。そのような腫瘍の特徴により、特定サイズの分子ががん腫瘍だけに到達し、留まる現象がEPR効果です。多くのタイプのDDSが、サイズを約10〜100 nmにすることで、EPR効果を利用してがん細胞だけに薬を運び作用させようとしています。
「L-PGDS分子1個(単量体)の大きさは5 nmほどですが、連結した多量体をつくれば、サイズを大きくしてEPR効果を利用できます。2量体と4量体をつくってSPring-8でSAXS測定したところ、2量体は8 nm、4量体は12 nmほどになりました。4量体をマウスに投与してEPR効果を確かめるとともに、8量体をつくる実験も進めています」(図4)
前例のないタンパク質製DDSの実用化を目指す
「高校生のころは、神の手を持つ心臓外科医に憧れました」と語る乾さん。「私は今、55歳。現役の研究者として働くことができる10年以内に、L-PGDS製DDSを利用した副作用のない抗がん剤を実用化したいですね。それには、製薬企業との連携が欠かせません。L-PGDSは安全性が高いことを確かめましたが、タンパク質製DDSの実用化は前例がありません。そのため二の足を踏む製薬企業がほとんどです。マウスの実験などで、がんの治療効果が高く、副作用がほとんど出ないことを示すことができれば、製薬企業も一歩を踏み出してくれるでしょう」

SPring-8で語り継がれる最年少記録の学生さん
SPring-8の利用支援を行っている高輝度光科学研究センターの八木直人さんは、「三重短期大学の学生さんのモチベーションの高さはすごかった!」と、2002年の出来事を振り返ります。乾研究室の学生さんのことです。
「SPring-8でL-PGDSのSAXS測定をするために人手が必要でした。SPring-8で実験をしたい人と学生に聞いたところ、各務智子さんと岸田麻利江さんの手が上がりました。彼女たちは短大2年生の20歳で、SPring-8の実験に参加した最年少記録でした。割り当てられた測定時間(ビームタイム)が限られている中、本当によく働き、実験を進めてくれました」と乾さん。「最近も、L-PGDSのX線結晶構造解析などを行うために学生たちがSPring-8で実験を進めています」
乾研究室に受け継がれる、学生の皆さんの高いモチベーションが、L-PGDS製DDSの実用化への道を切り拓いていくことでしょう。

三重短期大学 乾研究室(2002年度)

大阪府立大学 乾研究室(2017年度)
文:フォトンクリエイト 立山 晃
この記事は、大阪府立大学大学院 生命環境科学研究科 応用生命科学専攻 生体高分子機能学研究室の乾 隆 教授にインタビューして構成しました。