水素を発生させる酵素を作り上げるタンパク質群の立体構造の解明(プレスリリース)
- 公開日
- 2007年07月06日
- BL41XU(構造生物学I)
- BL44B2(理研 物質科学)
平成19年7月6日
京都大学
|
京都大学大学院理学研究科 三木邦夫教授,渡部聡研究員(現・理化学研究所)らは,京都大学大学院工学研究科 今中忠行教授,跡見晴幸准教授,松見理恵研究員,理化学研究所播磨研究所との共同研究で,水素酸化還元酵素である[NiFe]ヒドロゲナーゼを生体内で作り上げる成熟化因子のタンパク質群の立体構造の決定に世界で初めて成功しました. 水素は,燃焼しても水が生成するだけであり,石油等の化石燃料に代わる最もクリーンな次世代エネルギーとして期待されています.微生物には,水素を生成する能力があることが知られており,これはヒドロゲナーゼというタンパク質(酵素)の働きによるものです.ヒドロゲナーゼは,プロトン(H+)から水素分子を可逆的に発生させる酵素で,水素の触媒開発研究などの点から注目されています.水素分子の合成は,ヒドロゲナーゼの活性部位に存在する複雑な金属クラスターで行われており, [NiFe]ヒドロゲナーゼの場合,金属クラスターは,有毒なシアノ基や一酸化炭素が配位した鉄原子とニッケル原子で構成されています(図1参照).このようなタンパク質は遺伝子の情報をもとに,生体内で作られていきますが,遺伝情報をアミノ酸の種類に翻訳すれば,正しく機能するタンパク質が自発的に作られるわけでは決してありません.タンパク質分子が生体内で作り上げられ,その機能を獲得するためには,多くの周りからの助けが必要とされます.例えば,アミノ酸の重合体として合成されたタンパク質は折れたたまれることでかたち(立体構造)を形成しますが.その場合も折れたたみを助ける因子が必要ですし,今回のヒドロゲナーゼのように金属クラスターをもつタンパク質の場合には,金属原子やその配位子を組み込む役目(成熟化と呼んでいます)をする因子が必要です.これらのタンパク質の折れたたみを助けたり,成熟化する因子も,通常,タンパク質がその役目を担っています.すなわち,他のタンパク質が作られるのを助ける役目をするタンパク質があるのです.ヒドロゲナーゼの水素合成に必須であるニッケル鉄クラスターは,多数の成熟化因子(成熟化タンパク質)によって段階的にヒドロゲナーゼに組み込まれることが分かっていますが,その詳細な反応機構については明らかになっていませんでした. (論文) |
<研究の背景>
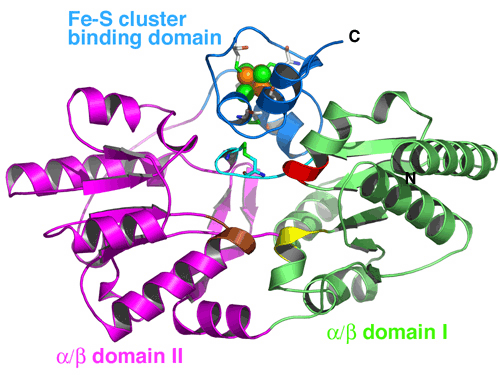
[NiFe]ヒドロゲナーゼは,プロトン(H+)から水素分子への可逆的な酸化還元反応を触媒する酵素であり,多くの細菌におけるエネルギー代謝に関わっています.石油にかわる最もクリーンな次世代エネルギーとして考えられている水素を発生できる[NiFe]ヒドロゲナーゼは,水素エネルギー開発研究の点からも注目されています.水素の酸化還元を行う活性中心には,鉄とニッケルで構成された金属クラスターが存在しており,鉄には,さらに二つのシアノ基と一酸化炭素が配位しています.このニッケル鉄クラスターは,自発的に作られるのではなく,その合成のために複数の成熟化因子(Hypタンパク質とよばれる: HypABCDEF)を必要とします.Hypタンパク質群によって鉄やニッケルが段階的にヒドロゲナーゼに組み込まれることでクラスターが生合成され,水素を合成する能力のあるヒドロゲナーゼが作られます.特に生物にとって有毒なシアノ基を合成し鉄原子に配位させる精巧な反応においては,4つの因子HypC, HypD, HypE, HypFが関与しています.HypC(分子量8kDa)は,分子シャペロンとして機能しており,鉄原子の組み込みに関与しています.HypD(分子量42kDa)は,分子内に鉄硫黄クラスター[4Fe4S]を含むタンパク質で,鉄原子の修飾および組み込みに関与しています.HypE(分子量36kDa)はHypFと協同でカルバモイルリン酸とATPからシアノ基を合成する反応を触媒します.合成されたシアノ基は,HypEからHypCとHypD構成された複合体に受け渡されることは分かっていますが,鉄原子にシアノ基を配位させる反応機構の詳細については,明らかになっていませんでした.
<研究成果の内容>
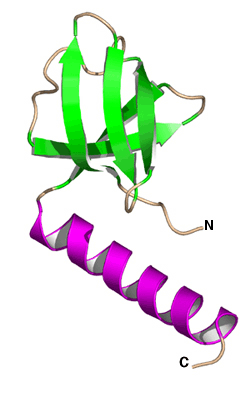
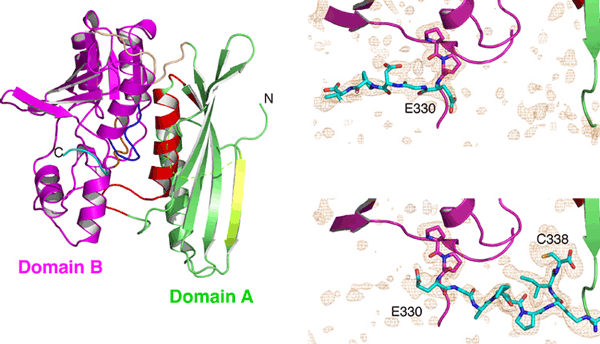
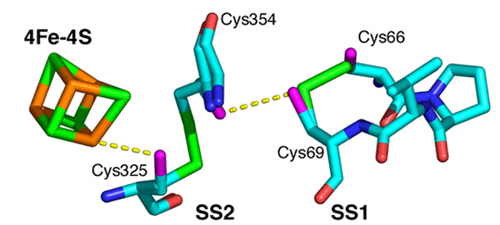
研究グループでは,60℃〜100℃で生育可能な超好熱始原菌Thermococcus kodakaraensis KOD1由来のヒドロゲナーゼ成熟化因子Hypタンパク質群の中の3因子,HypC, HypD, HypEについて,それぞれ結晶化に成功して,SPring-8(構造生物学IビームラインBL41XUおよび理研構造生物学IIビームラインBL44B2)等の放射光施設を利用して結晶構造を決定しました.構造解析の結果,HypCは,コンパクトな二つのドメインで構成されており,非対称単位中の分子比較から,ドメインの相対配置が柔軟に変化しうることが分かりました(図2).HypEは,二つのドメインで構成されており,ATPとの結合に伴って,保存されたC末領域を分子の内側と外側とに大きく構造変化させていることが分かりました(図3).HypDは,3つのドメインで構成されており,新規のタンパク質フォールドであることが分かりました(図4).HypDの保存残基がHypDの分子中央のクレフトに活性部位を形成していることが明らかになり,活性部位周辺においてHypCおよびHypEと相互作用して複合体を形成し,鉄原子のシアノ化が行われることが示されました.また,HypDの内部において,保存された4つのシステイン残基と鉄硫黄クラスターが,連続的に配置していることが分かり,チオール基の酸化還元カスケードの存在が明らかになりました(図5).これらの結果から,鉄原子に2つのシアノ基を配位させる反応は,HypCDE複合体におけるシステイン残基の連続的な酸化還元反応によって行われていることが示唆されます.これらの成果は,生物が行う複雑な金属錯体形成機構の理解に大きく貢献し,水素エネルギー開発のためのヒドロゲナーゼの応用研究に活用されることが期待されます.
<参考資料>
| <お問合せ先>
(本研究に関すること) 京都大学大学院理学研究科化学専攻 (SPring-8に関すること) 財団法人高輝度光科学研究センター 広報室 |
- 現在の記事
- 水素を発生させる酵素を作り上げるタンパク質群の立体構造の解明(プレスリリース)
![図1 [NiFe]ヒドロゲナーゼの全体構造(左図)とその活性中心の構造と反応(右図)](/ja/news_publications/press_release/2007/070706_fig/fig1_png.png)