インフルエンザウイルスのRNAポリメラーゼの構造を解明! - 新型インフルエンザウイルスに対する新規薬剤設計が可能に - (プレスリリース)
- 公開日
- 2008年07月28日
- BL41XU(構造生物学I)
2008年7月28日
横浜市立大学
☆ 研究成果のポイント
○ サブユニット間の結合構造をX線結晶構造解析により解明
○ サブユニット結合に重要なアミノ酸残基を同定
○ アミノ変異によるサブユニット結合阻害が、ポリメラーゼ活性を低下させることを確認
○ 阻害剤設計による抗新型ウイルス薬発見に期待
|
横浜市立大学大学院国際総合科学研究科の尾林栄治特任助教と朴三用准教授らは、インフルエンザウイルスの複製に中心的な役割を果たしているRNAポリメラーゼのサブユニット間の構造を世界で初めて原子レベルで解明しました。この研究は、筑波大学基礎医学系・永田恭介らとの共同研究*1による成果です。 (論文) |
1.背景
インフルエンザは、ウイルス感染によって引き起こされ、日本でも毎年冬になると決まって流行する病気として広く知られています。近年では、鳥インフルエンザウイルスの人への感染による世界的大流行が懸念されており、日本でもタミフルなどの備蓄に大変な金額が注がれています。しかし、既にタミフル耐性型の鳥インフルエンザウイルスが発見されるなど、ウイルスの変異は頻繁に起こりうるため、このような新型ウイルスに対するワクチンや新薬の開発が世界中で積極的に行われています。
2.研究手法と成果
(1) インフルエンザウイルスのRNAポリメラーゼPA-PB1サブユニット間結合の構造解析
PAのC末端領域(239-716)とPB1のN末端領域(1-80)とが結合した複合体を調製し、その結晶化に成功しました。この結晶を用いて、大型放射光施設SPring-8の構造生物学IビームラインBL41XUおよびPFでX線結晶構造解析を行い、PA-PB1複合体の原子レベルの構造を明らかにしました。PAはこれまでに解明されている蛋白質にはない新規な形をしており、13個のαへリックスと9個のβシートで構成されていました(図1)。また、その3つのへリックスによりトンネルが構成されており、そこにPB1のN末端が突き刺さるように結合していました(図1)。この際、PB1は310へリックスと呼ばれる構造をとっており、蛋白質間結合として非常に珍しい様式であることが確認されました。
(2) 変異蛋白質の機能解析
PA-PB1複合体の立体構造上、PAとPB1の結合に非常に大きく貢献していると思われるアミノ酸を、その結合を不安定にさせるようなアミノ酸に置換し、その結合能と、RNAポリメラーゼの転写活性を解析しました。PAサブユニットのVal 636、Leu 640、Leu666とTrp706を置換した変異体は、PB1のN末端領域に結合できなくなり(図2A)、またその転写活性は著しく低下していることが確認されました(図2B)。このことから、本研究結果で明らかになったPAのC末端領域(239-716)とPB1のN末端領域(1-80)間の結合が、RNAポリメラーゼ全体の機能に非常に重要な役割を果たしており、この結合能の欠失が直接ポリメラーゼ全体の不活性化につながることが強く示唆されました。
3.今後の期待
これまでに開発されている抗インフルエンザウイルス薬は、ウイルスが細胞に感染することを防ぐものであり、直接その複製を阻害するものではないために、感染後時間が経過してしまうとその効果が薄れてしまうことが問題となっています。また、効果が大きいとされるタミフルの備蓄に日本でも非常に多額の予算がつぎ込まれていますが、既にタミフル耐性型の鳥インフルエンザが発見されており、異なる視点から新薬開発に取り組む必要があります。今回、RNAポリメラーゼのサブユニット間の立体構造を明らかにしたことは、ウイルス複製に必須な部位を創薬ターゲットにすることを可能にし、抗インフルエンザウイルス創薬の新たな分野を開く成果となりました。今後、本構造を基にしたPA-PB1結合阻害剤が設計され、抗インフルエンザ薬として応用されることが期待されます。さらにこのような新薬は、ウイルスの変異に強く、またこれまでのワクチンとは違い、どんなタイプの新型インフルエンザウイルスにも効果が出る画期的なものに成ると期待されます。
*1 今回の共同研究チーム
本研究は以下の研究者との共同研究による
横浜市立大学大学院国際総合科学研究科生体超分子科学専攻設計科学研究室・朴三用准教授、Jeremy Tame教授、尾林栄治特任助教、大学院生、河合文啓氏、吉田尚史氏
筑波大学基礎医学系・川口敦史先生、永田恭介先生
自治医科大学・柴山修哉先生
<参考資料>
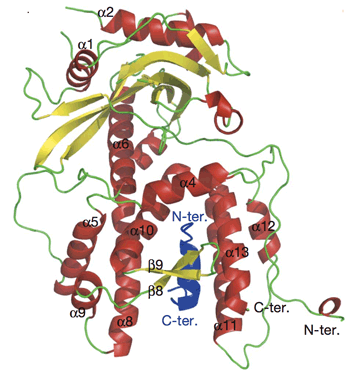 図1.インフルエンザウイルスのRNAポリメラーゼPA(238-716)-PB1(1-81)の結晶構造
図1.インフルエンザウイルスのRNAポリメラーゼPA(238-716)-PB1(1-81)の結晶構造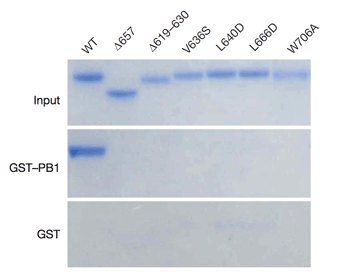 図2A.アミノ酸置換変異体による機能解析:
図2A.アミノ酸置換変異体による機能解析:PA(239-716)の野生型(WT)と変異体を、GST-PB1(1-14)を用いてその結合能を調べた。WTは非常によく結合しているが、Val 636、Leu 640、Leu666とTrp706を置換した変異体では、その結合能が失われていることがわかる。
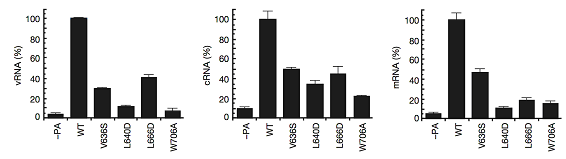 図2B.アミノ酸置換変異体による機能解析:
図2B.アミノ酸置換変異体による機能解析:変異体を用いたポリメラーゼ活性を野生型と比較したところ、Val 636、Leu 640、Leu666とTrp706を置換した変異体では野生型に比べ、40%以下と劇的にその活性が減少した。
|
<お問い合わせ先> (本研究成果の内容に関すること) (SPring-8に関すること) |
- 現在の記事
- インフルエンザウイルスのRNAポリメラーゼの構造を解明! - 新型インフルエンザウイルスに対する新規薬剤設計が可能に - (プレスリリース)