蛋白質の立体構造形成を促進する因子の構造解析に成功 - ヒト細胞における蛋白質品質管理機構の仕組みの理解に一助、神経変性疾患・免疫不全・糖尿病などの疾病の成因解明に期待 - (プレスリリース)
- 公開日
- 2010年09月11日
- BL44XU(生体超分子複合体構造解析)
2010年9月11日
九州大学
|
九州大学、大阪大学,Universita Vita-Salute San Raffaele Scientific Instituteの研究グループ(代表:九州大学生体防御医学研究所 稲葉謙次 特任准教授)は、ヒト細胞の中で蛋白質ジスルフィド結合を創りだす酵素Ero1の高分解能結晶構造解析に成功しました。これまで大腸菌や酵母などの蛋白質ジスルフィド結合形成因子の研究については進んでおりましたが、ヒトの同因子について分子構造と反応機構を解明したのは今回が世界で初めての例になります。 これにより、我々ヒトの細胞の中で蛋白質の立体構造が形成される仕組みの一端が解明され、細胞における蛋白質の品質が管理される仕組みが明らかになりました。これに加え、老化・動脈硬化・がんなどの要因となる活性酸素種(過酸化水素)を発生するEro1が、実は活性酸素種を発生し過ぎないよう自身の活性を巧妙に制御する仕組みがあることが分子構造レベルで解明されました。以上の成果により、今後は神経変性疾患、免疫不全、糖尿病などの疾病の成因解明が期待されます。 本研究成果は、欧州の科学雑誌The EMBO Journal (Nature Publishing Group発刊)のオンライン版に2010年9月10日付で掲載されました。 (論文) |
1.背 景
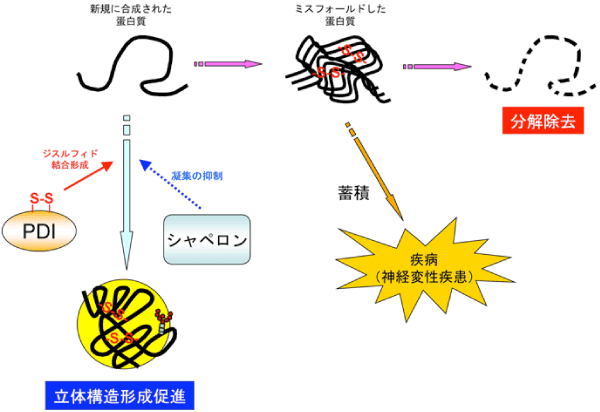
細胞の中には、新しく合成された蛋白質の立体構造形成を促すための補助システムが存在します。一方で、正しい立体構造がとれなかった蛋白質(ミスフォールド蛋白質)を速やかに分解除去するためのシステムも存在します。これらシステムが破綻すると、細胞内にミスフォールドタンパク質が過剰に蓄積し、それらが毒となって様々な疾病を引き起こすことが知られています(図1)。
蛋白質の立体構造形成において、ジスルフィド結合は重要な役割を担っています。ジスルフィド結合は、空間的に近くに位置する二つのシステインと呼ばれるアミノ酸が酸化されることにより形成される硫黄原子間の共有結合です。この結合が補強金具のように機能することで、蛋白質の立体構造は頑強なものになります。ジスルフィド結合は細胞膜表層や細胞外に分泌される蛋白質に多くみられ、細胞の中で合成される全蛋白質の約10%がジスルフィド結合をもちます。ヒト細胞における遺伝子の数が2万数千と言われていますので、ヒトが創りだす2千種類以上もの蛋白質がジスルフィド結合をもつと推定されます。ジスルフィド結合をもつ蛋白質として、免疫作用において中心的役割を担う免疫グロブリン(抗体)や、髪の毛や爪の主成分であるケラチン、さらにはインスリンや細胞成長因子などのホルモンが挙げられます。したがって、ジスルフィド結合をもつ蛋白質には、我々の日常生活や医学にも密接に関係するものが多く存在します。
2.内 容
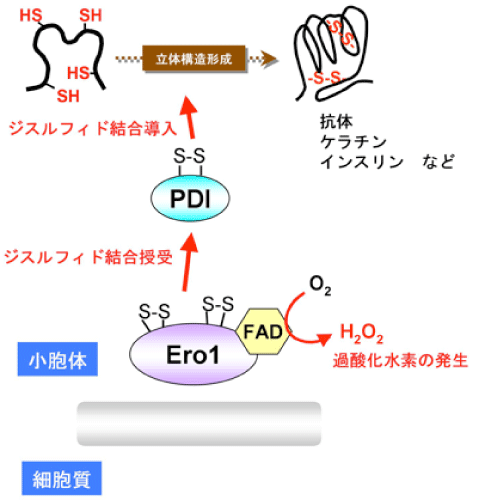
本研究では、大型放射光施設SPring-8 の生体超分子複合体構造解析ビームラインBL44XU(大阪大学蛋白質研究所の専用ビームライン)を利用して、ヒト細胞の小胞体1)中でのジスルフィド結合形成において中心的役割を担う酸化酵素Ero1のX線結晶構造解析に成功しました。Ero1は補酵素であるFAD2)および酸素分子と共役してジスルフィド結合を創りだし、そこで創られたジスルフィド結合はPDI (Protein Disulfide Isomerase)という因子に受け渡され、最終的に下流の多くの蛋白質にジスルフィド結合が導入されます(図2)。
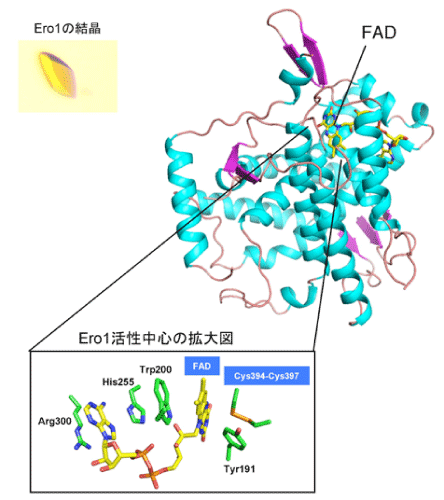
今回の研究により、Ero1の全体構造およびFADと酸素分子と共役してジスルフィド結合を創りだす反応機構の詳細が明らかとなりました(図3)。またEro1がPDIにジスルフィド結合を選択的に受け渡す仕組みについても、理解が進みました。さらにもう一つ重要な発見として、Ero1はジスルフィド結合を創りだす過程において老化・動脈硬化・がんなどの要因となる活性酸素種(過酸化水素)を発生しますが(図2)、Ero1が活性酸素種を発生し過ぎないよう自身の活性を巧妙に制御する仕組みについても分子構造レベルで解明しました。
以上の研究により、我々高等生物の細胞の中で蛋白質の立体構造形成が促進される仕組みの一端が解明されました。さらに、細胞中の酸化還元環境を感知しながらEro1自身の活性を制御することで、細胞の中で活性酸素種が発生し過ぎないように制御する仕組みについても大きく理解が進みました。
3.効果、今後の展開
我々は2006年、2009年にもSPring-8のビームラインBL44XUを利用して大腸菌における蛋白質ジスルフィド結合形成因子(DsbB-DsbA)の構造解析に成功しており(Inaba et al., (2006) Cell 127, 789-801; Inaba et al., (2009) EMBO J. 28, 779-791)、今回解かれたEro1の構造と比較照合することにより、これら酵素に共通する構造および反応機構が明らかとなりました。すなわち、高等生物細胞、バクテリアを問わず蛋白質ジスルフィド結合の形成に関わる細胞システムの普遍的な作用機序が明らかとなったと言えます。これら知見は、細胞における蛋白質の立体構造形成および品質管理の仕組みを理解する上で、非常に役立つものです。
細胞の中で蛋白質の立体構造形成がうまくいかない場合、ミスフォールドした蛋白質が過剰に蓄積し、様々な疾病を引き起こすことが知られています。実際、本研究の対象であるPDI-Ero1システムが機能不全に陥れば、パーキンソン病やアルツハイマー病など種々の神経変性疾患を引き起こすことが知られております。また、PDI-Ero1システムに依存して成熟化する蛋白質として、抗体や抗原提示分子さらにはインスリンなどが存在することから、本研究で得られた知見は免疫不全や糖尿病などの疾病の成因解明にもつながり得るものです。
現在ヒト細胞の中には、蛋白質ジスルフィド結合の形成に関わるPDIファミリーの因子が20種類近く同定されておりますが、その多くの因子の具体的な機能は依然未解明です。今後、蛋白質ジスルフィド結合の形成に関わる他の因子についても機能及び機能発現メカニズムが解明されれば、細胞における蛋白質品質管理機構に関する理解がさらに深まることが期待されます。
《参考資料》
《用語解説》
1)小胞体
真核細胞の小区画の一つ。ここで分泌蛋白質や膜蛋白質は合成される。ジスルフィド結合の形成や糖鎖の付加が起こる主要な場である。
2)FAD
flavin adenine dinucleotide(フラビンアデニンジヌクレオチド)の略。細胞の中で電子の授受に関わる補酵素で、ビタミンBの一種。
|
《問い合わせ先》 (SPring-8に関すること) |
- 現在の記事
- 蛋白質の立体構造形成を促進する因子の構造解析に成功 - ヒト細胞における蛋白質品質管理機構の仕組みの理解に一助、神経変性疾患・免疫不全・糖尿病などの疾病の成因解明に期待 - (プレスリリース)