がん遺伝子産物Ras蛋白質の新規ポケット構造情報に基づくインシリコ創薬:世界初のRasを分子標的としたがん治療薬開発の新たな扉を開く研究成果(プレスリリース)
- 公開日
- 2013年04月30日
- BL38B1(構造生物学III)
- BL41XU(構造生物学I)
2013年4月30日
国立大学法人神戸大学
|
神戸大学大学院医学研究科の片岡 徹教授と島 扶美准教授らの研究グループは、がんの約20%の原因となっているrasがん遺伝子産物(Ras)※1の機能を阻害することにより抗がん作用を示す分子標的がん治療薬(分子標的薬)※2の開発候補となる物質を発見し、その研究成果が、米国科学アカデミー紀要の電子版に発表されました。 写真: 神戸大学内(楠キャンパス)で行われた報道8社に対する記者会見の模様
左から熊坂博士(高輝度光科学研究センター)、島准教授、片岡教授(神戸大学大学院医学研究科) (論文) |
背景
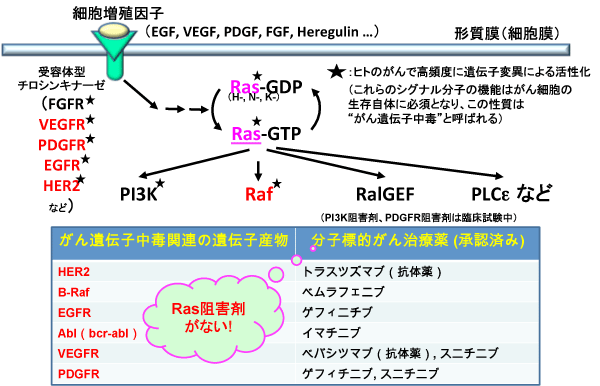
近年、がん遺伝子が作り出す蛋白質の機能を特異的に阻害することによりがん細胞の増殖を抑制するがん治療薬(分子標的薬)が複数開発され、イマチニブ※8などのいくつかのものは臨床の現場で画期的な治療効果を上げています(図1)。しかし、これらは限られたがん(イマチニブ:慢性骨髄性白血病※9)にのみ有効であり、広い範囲のがんの治療に有効なものはありません。
Rasは大腸がんや膵臓がんをはじめとする多くのがんで、遺伝子の突然変異による活性化(大腸がん:40~50%,膵臓がん:60~90%)が高率に認められていることから(図1)、がん治療薬開発の最も有望な分子標的と考えられます。Rasの機能阻害剤については、Rasの翻訳後脂質修飾※10の1つであるファルネシル化※11(Rasが細胞膜に移行し機能を発揮するのに必須)を阻害する薬剤(ファルネシル転移酵素阻害剤※12)が、がん治療薬候補として世界的に研究開発が進められてきました。しかし、臨床試験(治験)※13において腫瘍の縮小効果が認められるものの、患者さんの延命効果が認められないことから開発が頓挫した状況にあります。したがって、現在に至るまで、Rasを分子標的としたがん治療薬について、臨床の現場で使用しうるものが世界的に見ても全く存在しない状況にあります。
今回の研究成果
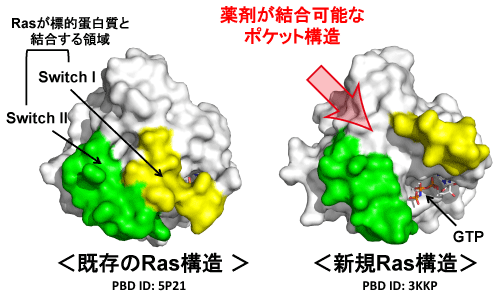
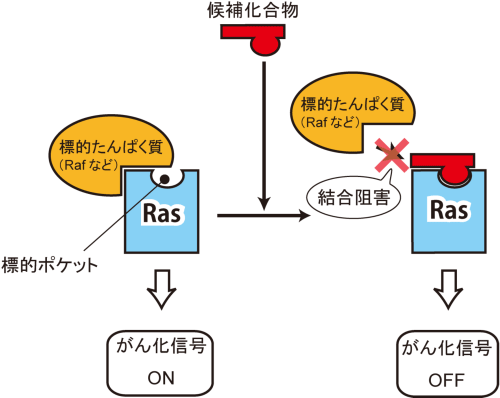
Rasのポケット構造は、神戸大学医学研究科分子生物学分野(http://www.med.kobe-u.ac.jp/molbiol/)が高輝度光科学研究センターと理化学研究所の協力のもと、細胞のがん化を引き起こすために重要なRasの下流の標的蛋白質※14(図1、PLCε※15など)の立体構造解析を進めている過程で、偶然発見されました。ヒトのがんと最も関連の深い3つのRasのアイソフォーム※16(H-, K-, N-Ras※17)の類縁体で、生体内での機能ならびに立体構造が未解明であったM-RasのX線結晶解析とNMR※18解析(神戸大学理学研究科・田村厚夫准教授との共同研究)がきっかけとなり、2005年、Rasにおける薬剤の結合可能なポケット構造が世界で初めて明らかになりました(Ye et al. 2005 J. Biol Chem. Vol. 280, p31267)。このポケットは、Rasが様々な下流の標的蛋白質と結合するために重要な働きをする2つswitch領域※19(switch Iとswitch II)の間に存在していました(図2)。したがって、このポケットに安定的に結合して、Rasと標的蛋白質との結合を阻害する物質は、Rasが関与するがん化のためのシグナル伝達を効果的に遮断する抗がん剤となりうることに着目し(図3)、我々は2005年度から、このポケットに結合するRas機能阻害物質の探索研究を開始しました。
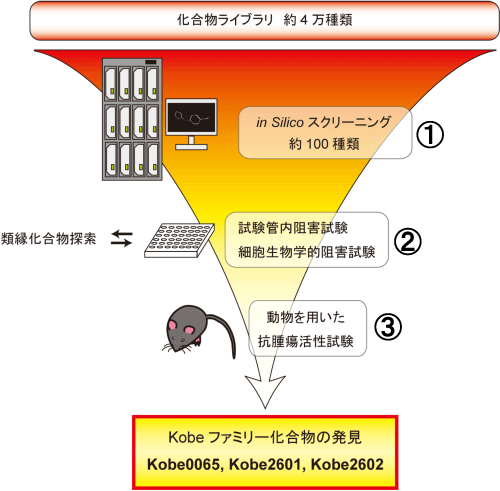
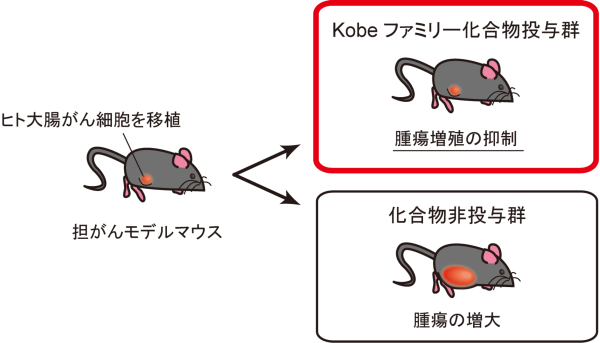
図4に示されますように、まず、我々が発見したRasのポケットにエネルギー的に安定に結合する物質を、約4万種類の低分子化合物※20(化合物)の情報を含むバーチャルライブラリー※21から、コンピュータドッキングシミュレーションを利用して約100種類選抜しました(図4の(1))。これらを実際に化学合成メーカーから購入し、Ras蛋白質(M-RasならびにH-Ras)と標的蛋白質の1つであるRaf蛋白質※22(cRaf1)との結合を実際に阻害するかどうか、生化学試験により1つずつ丁寧に活性を評価しました(図4の(2))。この生化学試験を唯一パスした化合物Kobe0065は、Rasが常時活性化※23(H-, K-RasG12V)しているがん細胞の細胞増殖を試験管レベルで顕著に抑制しました(図4の(2))。その後、Kobe0065の構造類似化合物のコンピュータスクリーニング※24(図4の(2)の左)と前述の生化学試験を通じて、さらに2種類の化合物(Kobe2601ならびに Kobe 2602)が見つかりました。これらの化合物(Kobeファミリー化合物)は、ヒトの大腸がん細胞(SW480/K-RasG12V)を移植したヌードマウスにおいても、顕著な腫瘍増殖抑制作用(抗がん作用)を示しました(図4の(3)ならびに図5)。
本研究の特色と今後の展開
Rasで初めてとなる薬剤の結合可能なポケットの発見を皮切りに、我々はRas機能阻害物質の探索研究を開始しました。2005年の開始当初は少ない予算内で候補物質のスクリーニングを行っていましたが、2006年度に医薬基盤研究所のインシリコ創薬※25の探索研究事業に採択され、大規模探索研究を開始することができました。2011年度からは、厚生労働省の政策創薬探索事業の補助金により、高輝度光科学研究センターならびに化学合成メーカーも含めた産学連携の枠組みの中で開発研究を精力的に進めています。
米国科学アカデミー紀要※26に掲載される今回の開発研究は、薬剤が作用するポケット構造の発見から候補化合物の同定に至るまで、製薬企業のサポートが全くない状況の完全インハウスで行われてきており、国内で製薬企業と大学とが共同で行う一般的な産学連携の研究開発とは全く性質が異なる、類を見ない開発例と思われます。
この論文で公開される3種類の化合物は、臨床試験に供するには、毒性および活性の点でまだ十分ではないため、現在、化学合成メーカーとの共同研究のもと、構造展開※27(化合物の構造改良)を進めています。医薬品開発には一般的に非常に時間がかかることが知られており、我々が発見し今回発表するRas機能阻害物質がすぐに臨床に使用されることはありませんが、研究成果を一部公開することによって、Ras機能阻害剤の研究開発を行っている世界中の企業ならびに研究機関での研究開発を加速させ、開発競争を通じて、真に臨床の現場で役立つ医薬品が一日でも早く患者さんの手元に届くように、という思いから情報開示を決定しました。一方で、神戸大学としては学内外の協力のもと、可能であれば開発品の臨床評価もインハウスで行えるような研究内容に育てていきたいと考えております。
《参考図》
がん遺伝子中毒関連の多くの細胞内シグナル伝達分子に対する分子標的がん治療薬が上市されているが、Rasを標的とした治療薬は存在しない。
新規構造(右:M-Ras)には、Rafをはじめとする種々の標的蛋白質(図1)との結合に重要な2つのswitch領域の間にポケット構造が存在する。一方、既知構造(左:H-Ras)の対応する領域にはポケット構造が存在しない。
Rasのポケットに結合する物質は、Rasと標的蛋白質との結合を阻害するため、細胞増殖(がん化)のためのシグナル伝達が抑制される。
(1)コンピュータシミュレーションによるポケット結合候補化合物の絞り込み、(2)精製Ras蛋白質ならびに活性型Ras(H-, K-RasG12V)を有する培養細胞を用いたRas機能阻害活性評価試験、(3)ヒト大腸がん細胞(K-RasG12V)を移植したヌードマウスでの腫瘍増殖抑制試験。
活性型Ras(K-RasG12V)を有するヒト大腸がん細胞SW480を移植したヌードマウスにKobeファミリー化合物を経口投与すると、非投与群と比較して有意な腫瘍増殖抑制作用が認められた。
《用語解説》
※1 rasがん遺伝子産物(Ras)
ラット肉腫(rat sarcoma)ウイルス由来のがん遺伝子(ras)ならびにその遺伝子産物の名称(Ras)。低分子量GTP結合蛋白質の一種で、細胞増殖、細胞の運動性の獲得のほか、細胞死の抑制など数多くの現象に関わっている分子である。 正常な細胞のゲノムに存在し(ras原がん遺伝子という)、遺伝子突然変異により活性化され、rasがん遺伝子となる。
※2 分子標的がん治療薬(分子標的薬)
がん細胞の持つ特異的な性質を分子(シグナル伝達分子)レベルでとらえ、それを標的として作用するように開発された医薬品の総称。正常細胞、がん細胞を問わず、細胞殺傷作用のみを狙った化学療法薬とは異なり、がん細胞を狙って作用するため、副作用をより少なく抑えながら、治療効果を高めると期待されている。
※3 コンピュータドッキングシミュレーション
低分子化合物と酵素などの生体高分子との相互作用において、その複合体の安定構造をコンピュータ上で計算的に推定する手法。受容体とリガンド、酵素と基質との結合エネルギーの算出など。
※4 ヌードマウス
遺伝子突然変異により生じた体毛が欠如したネズミで、胸腺が劣化あるいは欠損したために、Tリンパ球数の著しい減少が商事、その結果として免疫系が阻害されている。異なる動物種に由来する組織や腫瘍の移植に対して拒絶反応を示さないため、抗がん剤の作用評価などの実験に有用である。
※5 ロッシュ社
スイスのバーゼルに本社を置く世界的な製薬・ヘルスケア企業。1986年に創立し、ビタミン剤の生産で基盤を築いたが、1950年代以降は、抗不安薬の世界基準となるジアゼパム(日本における商品名「セルシン」)を開発・発売し、世界の抗不安薬市場を席巻し多くの利益を得た。1990年代以降は抗がん剤の開発に注力を始めている。
※6 ジェネンテック社
米国大手で世界でもトップクラスの成功を収めるバイオ製薬企業。ロシュが初めて株を取得した1990年当時のジェネンテックは、米サンフランシスコの小さなバイオ企業に過ぎず、研究中の有望な抗がん剤をいくつか持っていたが、開発を続けるための資金が不足していた。しかし現在、ロシュの豊富な資金力と臨床開発のノウハウのおかげで、ジェネンテックは、乳がん、肺がん、結腸・直腸がんの治療薬「Avastin(アバスチン)」、乳がん治療薬「Herceptin(ハーセプチン)」、がん治療薬の大ヒット医薬品をいくつも有するまでになっている。
※7 アボット社
1888年創業の米国イリノイ州にある製薬・ヘルスケアー企業。HIV血液検査薬、間接リュウマチ治療薬の「ヒュミラ」、HIV治療薬「カレトラ」、抗てんかん薬の「デパコート」など、広範囲に渡る医薬品を開発・提供している。
※8 イマチニブ
フィラデルフィア染色体の遺伝子産物Bcr-Ablチロシンキナーゼを標的として、ブライアン・ドラッカーとノバルティスファーマにより開発された分子標的がん治療薬。慢性骨髄性白血病、フィラデルフィア染色体陽性急性リンパ球性白血病などに対する治療薬として用いられる。
※9 慢性骨髄性白血病
造血幹細胞の遺伝子が後天的に変異して、造血細胞が分化・成熟能を保ったまま自律的な増殖を行った結果起こる、白血球や血小板などが増加する血液系の腫瘍。
※10 Rasの翻訳後脂質修飾
Rasが細胞膜に移行・結合して、受容体からのシグナルを受け取りその機能を発揮するためには、そのカルボキシ末端側にプレニル化と呼ばれる翻訳後脂質修飾を受けることが必須である。この修飾にはファルネシル化とゲラニルゲラニル化があり、これらの反応はそれぞれ、ファルネシル転移酵素ならびにゲラニルゲラニル転移酵素によって触媒される。
※11 ファルネシル化
Rasが細胞膜に移行するために必須のカルボキシ末端側に受ける翻訳後脂質修飾の1つで、ファルネシル転移酵素によって触媒される。
※12 ファルネシル転移酵素阻害剤
細胞内でのRasのファイルネシル化反応を阻害することにより、Rasの細胞膜移行の抑制を通じてRasの機能阻害を行う薬剤。Rasの分子標的がん治療薬の候補として開発され、臨床治験が行われているが、患者さんの延命効果は認められていない現状にある。
※13 臨床試験(治験)
医薬品もしくは医療機器の製造販売に関して、薬事法上の承認を得るために、多くの患者さんの協力を得て行われる検査試験。動物を使用した前臨床試験により医薬品候補物質もしくは医療機器候補の安全性および有効性を検討し、安全で有効な医薬品もしくは医療機器となりうることが期待される場合に行われる。薬事法の改正に伴い、企業の開発プロセスに乗る必要はなく、医師主導でも実施可能となった。
※14 標的蛋白質
細胞内シグナル伝達系のある蛋白質分子が直接作用し活性化する下流の蛋白質分子を指す。RasにはRaf, PI3K, PLCεをはじめとする複数の標的蛋白質が存在する。
※15 PLCε
リン酸エステル基の直前でリン脂質を切断する酵素Phospholipase Cの1つのアイソタイプ。PLCは構造的にβ、γ、δ、ε、ζ、ηの6つのタイプに分類され、哺乳動物ではβ1-4、γ1-2、δ1,3-4、ε、ζ、η1-2の合わせて13種類のサブタイプが同定されている。
※16 アイソフォーム
基本的な機能に関連する、アミノ酸配列は共通しているが、他の部分のアミノ酸配列は異なる蛋白質。ヒトのRasにはH-, K-, N-の3つのアイソフォームが存在する。
※17 H-, K-, N-Ras
それぞれHrvey-Ras、Kirsten-Ras、Neuroblastoma-Rasの略式型。
※18 NMR
原子核を強い静磁場中に置いて、特定の電磁波を照射した際に観察される電磁波の吸収現象を、核磁気共鳴(Nuclear Magnetic Resonance)と呼ぶが、この現象を利用して、原子核の周りの電子状態や原子間の結合状態を知ることで、蛋白質の立体構造情報を得ることができる。X線結晶構造解析と異なり、溶液中での立体構造情報を得ることができる。
※19 switch領域
Ras蛋白質のアミノ末端側に存在しRafをはじめとする種々の標的蛋白質との結合認識に重要な領域。switch I:32~38番目のアミノ酸残基群、switch II:60~75番目のアミノ酸残基群からなる。
※20 低分子化合物
一般的には薬物、ホルモン、栄養素などを意味するが、この場合は、分子量500以下程度の有機化合物を指す。
※21 バーチャルライブラリー
実際の有機化合物ではなく、コンピュータ上で発生させた有機化合物の立体構造の集合体(ライブラリー)。計算化学の手法を用いて医薬品などのスクリーニングを行う際に使用されることが多い。
※22 Raf蛋白質
rafがん遺伝子産物であり、低分子量G蛋白質Rasの最も有名な標的蛋白質の1つ。ATPを加水分解し、そのリン酸基を用いて標的蛋白質(MEK)をリン酸化して活性化する。
※23 常時活性化
常に蛋白質が活性化状態にあること。RasはGDP結合型(不活性型)とGTP結合型(活性型)という2種類のヌクレオチド型を行き来しながら、細胞増殖のシグナル伝達を調節する分子スイッチとして機能している。rasがん遺伝子の突然変異により、12番目あるいは61番目のアミノ酸に変異(アミノ酸の種類が変わってしまうこと)が起こると、Rasは常にGTP型で存在する(常時活性化する)性質を獲得するために、細胞増殖が止まらず細胞のがん化を引き起こす。
※24 構造類似化合物のコンピュータスクリーニング
この場合は、化合物のバーチャルライブラリーから、基本構造の類似した異なる低分子化合物をコンピュータ上で計算的に推定・選抜する手法。
※25 インシリコ創薬
従来の実験を主体とした医薬品の創出方法にIT(コンピュータならびにデータ通信技術の総称)技術を導入した創薬の手法。近年、医薬品創出のためのあらゆる段階の研究に利用されている。例)(1)ゲノム情報やマイクロアレイデータを利用した医薬品開発のための標的分子の探索、(2)標的蛋白質に作用する医薬品候補物質の探索、(3)医薬品候補物質の薬物動態予測など。
※26 米国科学アカデミー紀要
1914年に創刊された米国科学アカデミー発行の機関紙。Proceedings of the National Academy of Sciences of the United States of America、略称:PNAS または Proc. Natl. Acad. Sci. USA)。対象範囲は自然科学全領域のほか、社会科学、人文科学も含む。特に生物科学・医学の分野でインパクトの大きい論文が数多く発表されている。総合学術雑誌として、ネイチャー、サイエンスなどと並び重要。
※27 構造展開
医薬品開発候補となる可能性のある物質の活性と毒性を改善するための化合物構造の修飾ならびに改変。
|
《問い合わせ先》
国立大学法人神戸大学大学院医学研究科
(SPring-8に関すること) |
- 現在の記事
- がん遺伝子産物Ras蛋白質の新規ポケット構造情報に基づくインシリコ創薬:世界初のRasを分子標的としたがん治療薬開発の新たな扉を開く研究成果(プレスリリース)