アメフラシ由来の薬剤候補物質とアクチンの複合体三次元構造を解明 - 抗がん剤研究の新展開 - (プレスリリース)
- 公開日
- 2006年02月15日
- BL38B1(構造生物学III)
平成18年2月15日
(財)高輝度光科学研究センター
(独)理化学研究所
ポイント
・制がん活性を示す「アプリロニンA」と細胞骨格を形成するタンパク質の一つ「アクチン」との複合体構造解析に成功
・F-アクチン脱重合活性に及ぼす非常に重要な構造特性を解明
・既存の制がん剤とは異なる制がん性発現機構を持つ新たな制がん剤の開発に期待
|
高輝度光科学研究センターの平田邦生博士研究員、高田昌樹研究員、山本雅貴研究員(理化学研究所研究員)、筑波大学の木越英夫教授らは、制がん活性を示す 「アプリロニンA」と、細胞の骨格を形成するタンパク質の一つである「アクチン」との複合体構造を原子レベルで明らかにする事によって、アプリロニンAが アクチン分子の重合を阻害し、他の類似化合物に比べて有効な制がん活性を示す機構を明らかにしました。 (論文) |
1.背景
マクロライド化合物は、古くから薬剤としての特性を見出され、例えば抗生物質や鼻炎剤など多くの医療に関連する場面で利用されてきました。また、これら の化合物は生体内での現象、さらには化学反応などを研究するための道具としての貢献も非常に大きく、先の利用例と併せ、とりわけ薬理研究において非常に注 目を集めている化合物です。近年、海洋生物から単離される天然有機化合物について、それらが生体に及ぼす影響を調べ、薬剤として利用・応用するという研究 分野が注目を集めていますが、その中にはマクロライド化合物が多く含まれています。特に、抗がん剤として大きな効果を持つ天然マクロライド化合物が、どの ようなメカニズムで制がん活性を発現するのか?という疑問を解くことは、抗がん剤研究に大きく貢献します。
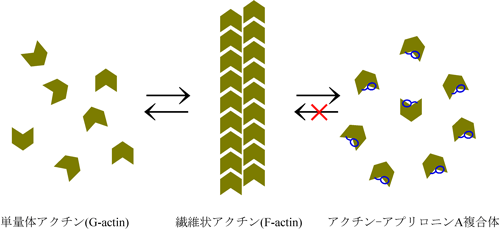
研究グループは、三重県の海岸に生息しているアメフラシから、アプリロニンAという新規マクロライド化合物を単離することに既に成功しています(図1)。 その制がん効果を調べたところ、アプリロニンAは、既存の制がん剤(マイトマイシンC)を上回る非常に強い制がん活性を示すことも既に解明しています。さ らに、アプリロニンAの生体標的分子の一つはアクチンであり、F-アクチンと呼ばれる繊維状のタンパク質凝集体を脱重合すること、また、F-アクチン脱重 合の際にアプリロニンAはアクチンと非常に強く結合し、1:1の複合体を形成することもわかっています。
これらの結果から研究グループは、アプリロニンAが制がん物質として非常に重要な天然化合物であると考え、アクチンとアプリロニンAの1:1複合体の結晶構造解析を行い、その制がん効果が生体内でどのように発現するのかを調べました。
2.結果
今回、得られた結晶は150x100x50ミクロン程度の柱状の結晶で、SPring-8のBL38B1を用いて、1.45Å解像度という非常に精度の高いデータ収集を行うことが出来ました。得られたデータは、これまでに構造解析されていたアクチン単量体の構造を用いて、分子置換法(※7)によって構造決定しました(図3)。
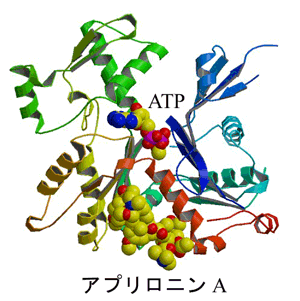
結晶構造中におけるアプリロニンAの立体構造などは、分光学的な手法によって決定されたものとよく一致しており、アクチン単量体部分の構造は、期待して いた大きな構造変化はなく、これまでに報告されていたclosed-form(閉じた)アクチンと呼ばれている構造に分類できることがわかりました。
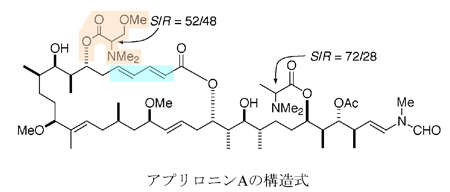
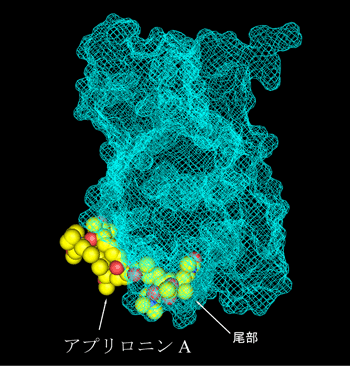
この複合体構造から重要な知見がいくつか得られました。まず、アプリロニンAが結合していたアクチンの疎水性クレフト(溝)は、通常、F-アクチン中で 隣のアクチン単量体が結合している部分でした。このことから、アプリロニンAは、本来、F-アクチン中で隣り合っている二つのアクチン分子の相互作用部分 に結合することによって、F-アクチンを脱重合すると考えらます。また、アプリロニンAは、マクロライド環と炭素鎖によって形成される尾部によって構成さ れていますが(図1)、この尾部がアクチンのクレフト部分に深く突き刺さっていたことから(図4)、 アプリロニンAの炭素鎖尾部は、アクチンの脱重合活性に非常に重要な役割を果たしていることも明らかになりました。この結果は「アプリロニンAの尾部を人 工的に除いた類縁の化合物は、F-アクチン脱重合活性を全く持たない」という、研究グループが以前明らかにした研究結果とよく一致しています。
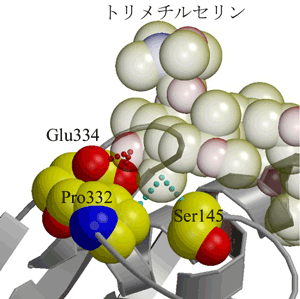
同様に、様々なアプリロニンAと類縁の化合物を用いた研究結果から、アプリロニンAのがん細胞に対する細胞毒性に重要な官能基は、トリメチルセリンとジエンであることがわかっていました(図1)。今回は、ジエン部分に関する特別な知見は得ることが出来ませんでしたが、トリメチルセリン部については、アクチンの分子表面から大きく突出した構造を持っているという、非常に特殊な構造的特徴が見出されました(図5)。 さらに、いくつかの相互作用によって、この官能基の特徴的な形状が保持される構造(アンカー構造)が形成されていることも明らかになりました。このアン カー構造がないアプリロニンAの類縁化合物は、がん細胞に対する細胞毒性が著しく低くなることから、トリメチルセリン部の突出、その形状を保持するアン カー構造はアプリロニンAの制がん活性と非常に密接に関連していると考えられます。
3.展望
最近、ある種のがん細胞にF-アクチン脱重合活性を持つ物質を投与すると、その細胞のアポトーシス(細胞の自殺)が誘導されるという報告がなされていま す。がん細胞のアポトーシスを制御できれば、それは抗がん剤の発明を意味します。アプリロニンAは、F-アクチン脱重合活性を有しているので、がん細胞に 対してこの種の作用を持つ可能性があります。さらに、アプリロニンAの類縁化合物の中でF-アクチン脱重合活性を持つにも関わらず、がん細胞に対する細胞 毒性をほとんど持たない物質が存在したことから、脱重合活性はアプリロニンAの制がん活性に必要な条件ではあるが、抗がん剤の完成にはさらに付加的な化学 的性質が必要であると考えられます。
今回の研究成果により、既存の制がん剤とは異なる制がん性発現機構を解明する糸口が見つかったと言えます。研究グループは今後、アプリロニンAのがん細 胞に対するアポトーシス研究などを行うことで、アプリロニンAが制がん活性を発現するメカニズムの解明、さらには抗がん剤の開発を目指しています。
<参考資料>
左半分は主にマクロラクトン環で、右半分は主に炭素鎖で構成されている。図中、ピンク色でトリメチルセリンを、水色でジエンを取り囲んでいる。原子間を結 ぶ線が太い部分は紙面から手前側、点線部分は紙面より向こう側に結合が出ていることを表現している(立体配置)。S/Rは矢印で示した炭素原子を中心に正 四面体構造が反転(立体配置が反転する)している状態を比率で示している。Meはメチル基(CH3)を示している。
アプリロニンAは繊維状アクチン(F-アクチン)を脱重合し、その後、その複合体が再度F-アクチンに戻ることを阻害する。なお、アプリロニンAは直接、単量体アクチンとも複合体を形成することが出来る。
アクチンはリボン図、アプリロニンAとATP(アデノシン三リン酸)はCPKモデル(球体のモデル)で表示してある(黄色:炭素、赤:酸素、青:窒素)。アプリロニンAは疎水的なアミノ酸で構成されている「疎水性クレフト(溝)」に結合していることがわかった。アクチン自体には大きな構造変化は無かった。
アクチン部分は水色のメッシュで分子の外形のみを示している。この図で、アプリロニンAの尾部がアクチン分子に深く差し込まれていることがわかる。
アクチンの構造は灰色のリボン図、アプリロニンAは半透明のCPK図で示してある。Glu、Pro、Serは、トリメチルセリンの突出構造を固定する(アンカー構造)のに必要だと考えられるアクチン中のアミノ酸残基で、それぞれ、グルタミン酸、プロリン、セリンを表している。それぞれ、CPK図で表示されており(黄色:炭素、赤色:酸素、青色:窒素)、数字はアクチンを構成するアミノ酸残基全て(およそ380残基)に順に与えられた番号(アミノ酸番号)を示している。水色と赤色の点線はそれぞれ、アクチンとアプリロニンAの間の疎水的な相互作用と親水的な相互作用を示している。
<用語解説>
※ 1.マクロライド化合物
大きなラクトン環を有する物質の総称。ラクトン環は環状のエステル(酸とアルコールの化合物)のことをさす。アプリロニンAは大きなラクトン環(マクロラクトン環)を有するので、マクロライド化合物に分類される。
※ 2.延命効果測定
がん細胞を腹腔内に移植したマウスに薬剤を投与し、延命効果を調べる実験。
※ 3.F-アクチン
繊維状アクチン「fibrous actin」を略して呼ぶ。生体内では単量体のアクチンとF-アクチンが図2に示したように平衡状態を保っており、状況に応じて重合・脱重合を繰り返すことにより、細胞の分裂や運動など重要な生物現象を制御している。ちなみに単量体アクチンはG-アクチン(globular actin)と呼ばれることもある。
※ 4.脱重合
高分子から単量体に分解していく反応。重合とは、単量体が化学反応によって高分子を形成していく反応であるが、脱重合はその逆。
※ 5.官能基
機能を持った分子のパーツ。
※ 6.タンパク3000プロジェクト
約3000種以上のタンパク質の構造およびその機能の解析をし、さらに得られた成果を特許化、産業移転するまでを考慮した国家プロジェクト。
※ 7.分子置換法
X線回折実験データを解釈するための位相決定法のうちの一つ。タンパク質の構造(今回はアクチン)が既知の場合に用いられる方法。データ収集後、すぐに 測定データを使って結晶構造の電子密度を見ることが出来るという長所がある。今回のように、構造既知のタンパク質と新しい薬剤との相互作用の構造解析に非 常に有効で、広く用いられている。
|
<本研究に関する問い合わせ先> (独)理化学研究所 播磨研究所 研究技術開発室 筑波大学 数理物質科学研究科・化学系 <SPring-8についての問い合わせ先> |
- 現在の記事
- アメフラシ由来の薬剤候補物質とアクチンの複合体三次元構造を解明 - 抗がん剤研究の新展開 - (プレスリリース)