ヒトDNA組み換え修復の分子メカニズムの一端を解明― 生体内におけるDNA修復機構をX線結晶構造解析から明らかに―(プレスリリース)
- 公開日
- 2002年08月16日
- BL45XU(理研 構造生物学I)
平成14年8月16日
理化学研究所
|
理化学研究所(小林俊一理事長)は、ヒトの生体内において遺伝子損傷の修復に中心的な役割を果たすタンパク質の立体構造を決定し、その修復機構を解明することに世界で初めて成功しました。理研播磨研究所細胞情報伝達研究室(横山茂之主任研究員)の協力のもと、理研横浜研究所ゲノム科学総合研究センター(和田昭允センター所長)タンパク質構造・機能研究グループの横山茂之プロジェクトディレクター、胡桃坂仁志研究員、香川亘ジュニア・リサーチ・アソシエイト(東京大学大学院)らの研究グループによる成果です。 |
1.背景
傷ついたDNAの修復は、細胞が正常に機能するために不可欠なメカニズムです。DNA修復機構が欠損すると、細胞のがん化や遺伝病につながることが知られています。今までの研究から、がんを頻発する遺伝病の原因遺伝子がDNA修復に深く関わっていることが明らかにされてきました。DNA修復機構は全ての生物が持ち合わせているものですが、特にヒトの場合、進化の過程で複数のDNA修復経路を獲得しており、それらはDNAが受けた損傷の種類によって役割分担をしていると考えられています。
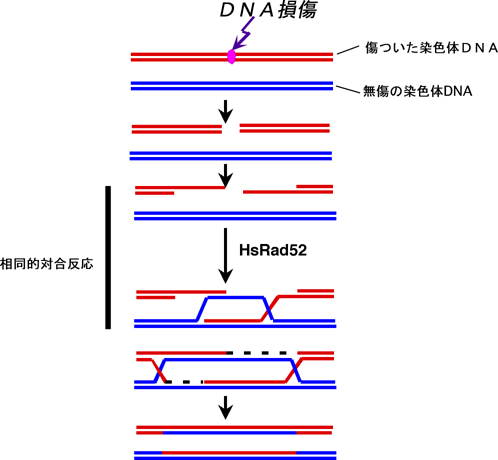
DNA損傷の中でも、DNAの二重鎖切断は、放射線や化学療法剤などの外的要因、または体内に生じた活性酸素やDNA複製のエラーなどの内的要因によってしばしば引き起こされます。このタイプのDNA損傷は、相同DNA組み換え※1によって修復されます。相同DNA組み換えが欠損した細胞では、DNAの二重鎖切断が修復されずに蓄積し、染色体間での無秩序なDNA組み換えを誘発します。その結果、染色体異常がおこり、細胞はその秩序だった増殖調節能を失い、やがてがん化します。この相同DNA組み換え機構の中では、DNAの二重鎖切断部位と同じ塩基配列を無傷の染色体の中から見つけだして、二分子の染色体の間でDNAを組み換える「相同的対合反応(図1)」が非常に重要です。
研究グループでは、相同的対合反応を行い、二重鎖DNA切断の修復の中核となるヒトRad52タンパク質に着目。相同的対合に関わるドメインの立体構造を決定し、立体構造に基づいた生化学的解析によってRad52による作用機構の解明を試みました。
2.研究の手法
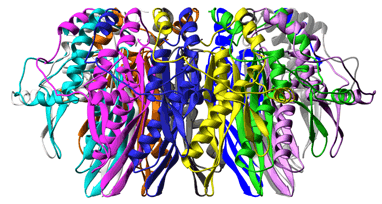
ヒトRad52遺伝子は、まず、全長である418アミノ酸からなるもの (Rad52 longer form:全長型Rad52)と、スプライシングバリアント※2である約200アミノ酸からなるもの(Rad52 shorter form:短縮型Rad52)の2種類のタンパク質を産生しています。両者ともDNAに結合し、相同的対合反応を促しますが、それぞれの役割・構造などの詳細は明らかになっていませんでした。研究グループは、全長型Rad52の役割を明らかにすることを目的に、まず全長型Rad52をプロテアーゼで分解する「限定分解法※3」によって、相同的対合反応を促す、独立したドメイン構造を見つけました。この領域は、N末端から約200アミノ酸までの領域であり、短縮型Rad52に対応します。次に、Rad52の1番目から212番目までのアミノ酸領域からなるRad521-212をデザインして単離・精製し、優れた単結晶を作製(図2)。大型放射光施設(SPring-8)の理研構造生物学Iビームライン(BL45XU)を用いて、多波長異常分散(MAD)法※4で立体構造を決定しました。
3.立体構造の解析結果から明らかになったこと
SPring-8からの高輝度なシンクロトロン放射光により、最終的には2.85 Å※5の高分解能のX線解析データを得ることができました。これらのデータを解析し、得られた立体構造から、Rad521-212のDNA結合領域を推測することができました。さらに部位特異的にアミノ酸変異を導入する方法を用いて、DNA結合に重要なアミノ酸が領域内に存在することを証明しました。
1)「Rad52短縮型は11量体のリング構造を形成している」
これまで、電子顕微鏡観察や生化学的解析などから、全長型Rad52は、7量体のリング構造を形成することが推定されていました。今回の結晶構造解析により、短縮型Rad52は、全長型とは異なり11量体のリング構造を形成することが分かりました。このように、同一遺伝子から作られる2つのタンパク質が、7量体と11量体という異なった会合体を形成する例はこれまでに報告されておらず、今回のケースが世界で最初の報告となります(図3)。
2)「Rad52リングの外周には、DNA結合を行うための溝が存在する」
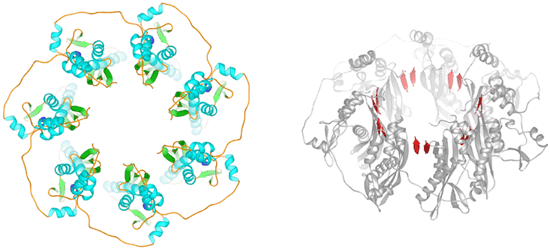
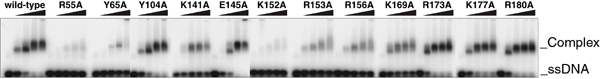
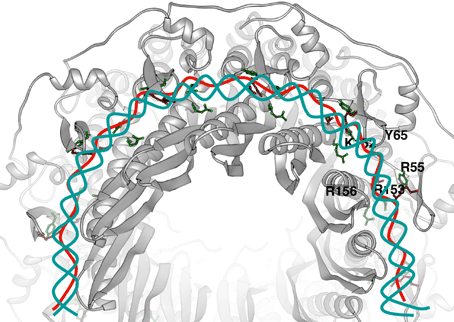
短縮型Rad52の11量体リング構造の表面電荷を解析した結果、リングの外周に塩基性アミノ酸が局在している溝が存在することが分かりました。DNAは酸性の物質であるため、この塩基性の溝がDNAとの結合部位であると予測されます。そこで、この塩基性の溝の中に側鎖を突き出しているアミノ酸を立体構造より同定し、部位特異的にアミノ酸変異を導入する方法によって、アミノ酸をアラニンに置換した変異体Rad521-212を12種類作製しました。これらの変異体Rad521-212とDNAとの結合を生化学的に解析した結果、この塩基性の溝が単鎖DNAと二重鎖DNAの両方を結合し、両者の間で相同的対合反応を促すDNA結合部位であることが明らかになりました。また、この塩基性の溝の中に側鎖を突き出しているアミノ酸こそが、DNA結合に直接関係するアミノ酸であることが分かりました(図4)。
3)「7量体を形成するRad52全長型のリング構造のモデルを提案」
決定した短縮型Rad52単量体の立体構造から、全長型Rad52の7量体形成モデルを構築しました。短縮型Rad52では、単量体当り3本のβシート構造が樽状につながって(βバレル構造)リング構造を形成していますが、全長型Rad52の7量体モデルでは、5本のβシートからなるβバレル構造によってリング構造が形成されると予測されます。また、全長型Rad52の7量体モデルにおいても、DNA結合溝は11量体と同様にリングの外周に位置しており、全長型Rad52と短縮型Rad52が同様のメカニズムで相同的対合反応を触媒することも推定されました。つまり、両者は、構造が異なるが、作用機構はほぼ一致していることを示唆しています(図5)。
4.今後の展開
本成果によって、今までヴェールに包まれていたDNA組み換え修復の分子機構の一端が明らかになりました。また、ある種のがん細胞においてRad52における変異が見出されていることから、DNA組み換え修復欠損による発がんのメカニズムの解明に重要な知見を与え、さらにはRad52の機能不全を原因とする腫瘍形成に対する薬の創製にもつながると考えられます。またRad52は、生体内のDNA組み換えをつかさどる中核的タンパク質であることから、DNA組み換え技術として分子生物学的分野で応用できる可能性があります。将来的には、人工的にDNA組み換え反応を生体内で行う遺伝子治療や、家畜や作物の品種改良などへ応用することも可能になるなど、医学、産業の場面で基盤技術として活用されることが期待されます。
《参考資料》
DNA損傷により二重鎖DNA切断を受けた染色体DNA(赤)が、DNA組み換え修復によって無傷の染色体DNA(青)を鋳型として修復する。
横から見た図(上)と真上から見た図(下)。単量体ごとに色を変えて表示してある。
Rad521-212の結晶構造を使用して構築した。赤で示したβシート構造は、Rad52 longer formで追加されると予測されたもの。
およびDNA結合に関係するアミノ酸をリング上に表示(下)
下図は、単鎖DNA(赤)と二重鎖DNA(青)の結合位置を示す。
|
問い合わせ先: 研究員 胡桃坂 仁志 (報道担当) |
|
<補足説明> |
| ※1 相同DNA組み換え 2分子のDNAの間でおこる組み換え反応の内、塩基配列の相同性に依存して行われるものを指す。生体内では、DNAの二重鎖切断を修復することに加え、精子や卵子などの配偶子を形成する過程で必須であり、両親のゲノムDNAの情報の再編成を行う。 ※2 スプライシングバリアント 真核生物の遺伝子には、本来タンパク質に翻訳されない領域が含まれており、遺伝子から転写によってmRNAが作られた後に、スプライシングというmRNAの切りつなぎによってタンパク質に翻訳されるべき領域のみが再編される。この過程で、同一遺伝子から作られた初期のmRNAから、異なった切りつなぎによって複数の若干ことなったタンパク質が作られることがある。このような、同一遺伝子に由来する、異なったタンパク質をスプライシングバリアントという。 ※3 プロテアーゼによる限定分解法 タンパク質分解酵素(プロテアーゼ)によって、立体構造を持つタンパク質を弱く切断すると、安定に立体構造を形成している部分は、プロテアーゼに切られにくいが、立体構造を形成していないループ状の領域はプロテアーゼによって切断される。このことを利用して、タンパク質内で安定に立体構造を保持しているドメインを同定する方法をプロテアーゼ限定分解法という。 ※4 多波長異常分散(MAD)法 MAD法とは、X線の波長を変えられる放射光を使って、波長に依存した原子のX線散乱の変化に基づいて解析する方法。これまでは、原子量の大きい金、白金、水銀などでラベルした質のよい結晶が複数種必要だったが、MAD法ではただ一つのラベルされた結晶を使った解析が可能になる。ただし、これによって測定できる信号は微小なため、これまでの方法より数段も精度の高い測定が必要となる。理研ビームラインIでは、「ダイヤモンドトリクロメータ」を用いることによって、発生した高輝度かつ高性能な放射光を3波長同時に取り出すことにより、MAD法でのデータ収集を効率的かつ高精度に行うことができる。 ※5 Å(オングストローム) 一般的には長さの単位を示す。1 オングストロームは 1 x 10-10 メートル(= 0.1 ナノメートル)。X線結晶構造解析においては、高次構造の解像度を示す単位として用いられる。数字が小さいほどより高解像度の立体構造であることを示す。 |
- 現在の記事
- ヒトDNA組み換え修復の分子メカニズムの一端を解明― 生体内におけるDNA修復機構をX線結晶構造解析から明らかに―(プレスリリース)