細胞運動を制御する分子メカニズムの一端を解明(プレスリリース)
- 公開日
- 2003年04月01日
- BL44B2(理研 物質科学)
- BL45XU(理研 構造生物学I)
平成15年4月1日
理化学研究所
|
理化学研究所(小林俊一理事長)は、細胞運動の調節に重要な役割を果たしているタンパク質の立体構造を決定し、その分子メカニズムを解明することに世界で初めて成功しました。理研播磨研究所構造生物化学研究室の山下敦子研究員、前田佳代協力研究員、前田雄一郎主任研究員らの研究グループによる成果です。 (論文) |
1.背 景
細胞運動は、発生過程における形態形成、神経系形成時の神経突起の伸張、免疫細胞の異物に対する細胞移動など、さまざまな重要な生体反応に関わっています。これらの細胞運動の多くは、アクチンというタンパク質分子が関与する「アクチン・ダイナミックス※1」という分子運動によって担われています。これは特定の時期に、細胞の特定の場所に、アクチンフィラメントが形成され、急速に伸びたり(重合)、アクチンフィラメントが急速に崩壊したり(脱重合)、という運動です。この細胞内でのアクチンの重合・脱重合の過程は、アクチン結合タンパク質とよばれる種々のタンパク質によって制御されています。なかでもアクチンフィラメントの末端をキャップして、アクチンフィラメントへのアクチン分子の重合やフィラメントからの分子の脱重合を防いでいる「キャッピング・プロテイン(CP)」というタンパク質は、この過程の制御の鍵となるタンパク質のひとつであるといわれています。このことは、キャッピングプロテイン(CP)がないと細胞運動ができなくなってしまうことからも証明されています。
さらに、キャッピング・プロテイン(CP)は、アクチンフィラメントの末端を細胞内の他のタンパク質や構造体につなぎとめる役割をしていると考えられています。例えば筋肉中においては、Z線という筋肉細胞内の仕切りにアクチンフィラメントをつなぎ止めており、筋肉形成を行うために必須の存在です。このことは、心臓でキャッピング・プロテイン(CP)の働きを抑えた遺伝子組み替えマウスでは、正常な心筋形成が行われず幼児期に死に至ることからもわかります。
キャッピング・プロテイン(CP)は、さまざまな生物種、細胞中に幅広く存在しており、非常によく保存されていることからも、生体内でのアクチンフィラメントの働きに重要な関わりをもつタンパク質であることがわかります。研究グループでは、筋肉細胞中におけるキャッピング・プロテイン(CP)であるCapZの立体構造を決定し、キャッピング・プロテイン(CP)の作用機構の解明を試みました。本研究は、文部科学省科学技術振興調整費総合研究“アクチンフィラメントの構造と動態の解析による筋収縮・調節機構の解明”(代表者、前田雄一郎;平成11年度―平成16年度の予定)によるものです。
2.研究手法と成果
CapZは、αとβという2つの異なるタンパク質が組み合わさって構成されている異種二量体タンパク質です。研究グループは、ニワトリ骨格筋由来CapZのαとβの2つのサブユニットを大腸菌内で同時に産生させ、これを単離・精製してCapZ試料を得て、結晶を作製しました。さらに大型放射光施設SPring-8の理研構造生物学ビームラインを用いて、多波長異常分散法※2で立体構造を決定しました。その結果、最終的に2.1Å※3のX線回折強度データ※4を得て、CapZ全体の構造を決定することができました。
解明された構造から、CapZ分子は細長い形状をしており、αとβの2つのサブユニットは、アミノ酸配列ではまったく類似性が見られないにもかかわらず、立体構造としては非常によく似ていることが明らかになりました。さらにその2つのサブユニットが、2回回転対称の関係で強固に組み合わさり、1つのCapZ分子を構成していることがわかりました。今回の構造をもとにこれまでの生化学データを検討すると、CapZのアクチン結合部位は、分子内に2ヶ所、αサブユニットとβサブユニットからそれぞれ1本ずつ2本の“腕”のように分子から突き出て存在していることが明らかになりました。また、この“腕”は分子の中で動きやすい構造をしていること、また、アクチンへの結合には“腕”の疎水性※5側表面を利用しているらしいこともわかりました。
アクチンフィラメントは、アクチン分子がらせん状に配列している構造をしているため、2回対称の構造をもつCapZとでは構造の対称性が異なります。しかし、CapZは“腕”が動きやすいこと、実際の両腕はアミノ酸配列が異なるため細かく見ると違いがあることを利用して、この対称性の違いを巧みに補正しアクチンフィラメントに結合していると考えられます。また、動きやすい“腕”と強固に構築された本体をもつCapZの構造は、アクチンフィラメントの細胞内でのダイナミックな性質を制御するのに有利であると考えられます。
3.今後の展開
アクチンフィラメントの重合・脱重合の過程は生体反応における重要なプロセスでありながら、アクチンフィラメント自体の高解像度での構造解析が現状では不可能なため、その詳細な分子メカニズムの理解にはまだ遠い状況です。今回、その調節の鍵を握るCapZの構造を原子レベルで解明したことは、CapZ自体が機能するメカニズムの理解を大きく深めただけにとどまらず、その作用相手であるアクチンフィラメントの性質を理解するという点においても一つの道を開いたものであるといえます。研究グループでは今後、さらにCapZとアクチンフィラメントの相互作用の詳細を明らかにし、アクチンフィラメントの性質やその重合・脱重合メカニズムを解明していく予定です。またCapZは、心筋など筋肉形成に必須のタンパク質でもあることから、本研究で明らかになった立体構造から得られる知見を生かして、心臓疾患や筋疾患など、いまだ明らかになっていない病因の解明やその治療法の開発などにつながる可能性があります。
《参考資料》
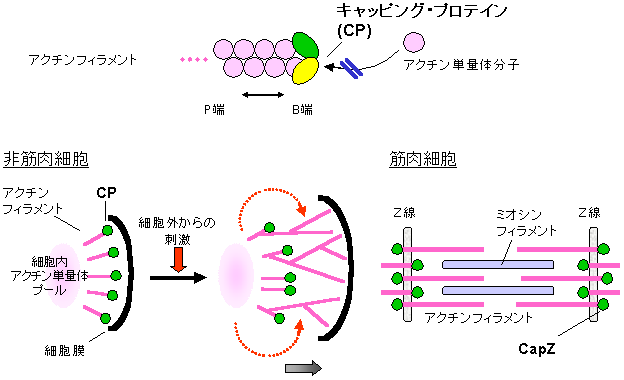
キャッピング・プロテイン(CP) はアクチンフィラメントのB端と呼ばれる側の末端に結合して、アクチンフィラメントへのアクチン分子の重合やフィラメントからの分子の脱重合を防いでいる。この働きは、細胞外からの刺激に応答して細胞運動を行うのに不可欠である。また、キャッピング・プロテイン(CP)はアクチンフィラメントの末端を細胞内の他のタンパク質や構造体につなぎとめる役割も果たしており、例えば筋肉中においてはZ線という筋肉細胞内の仕切りにアクチンフィラメントをつなぎ止めている。
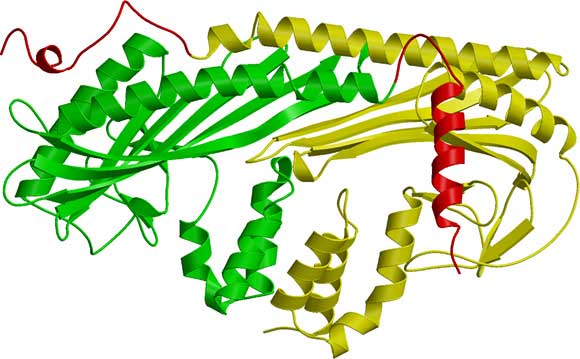
CapZの構造をリボン表示で示した図。αサブユニットを黄色、βサブユニットを緑で表示している。アクチン結合に使われる「腕」の部分を赤色で示している。
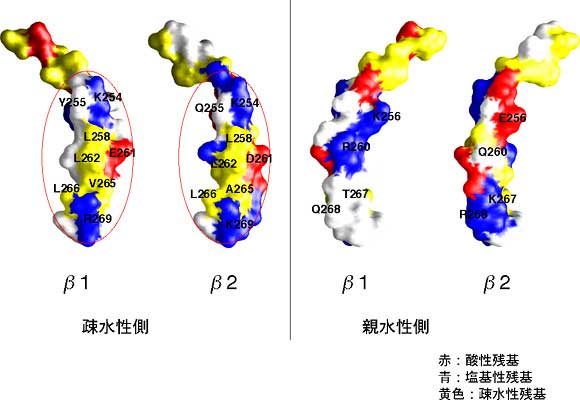
βサブユニットの腕を示す。腕の疎水性表面(左図。疎水性部分を黄色で表示)は種の違い(図中ではβ1、β2で例示)をこえて保存されており、こちら側の表面がアクチン結合に利用されていると考えられる。
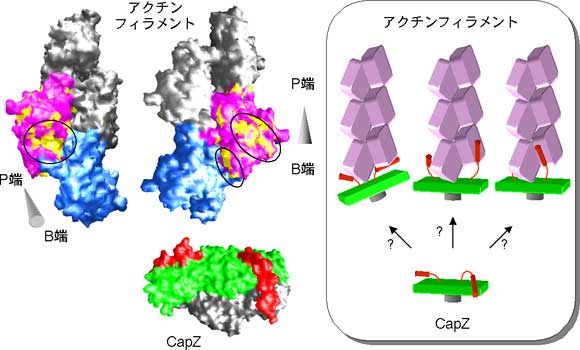
左図はアクチンフィラメントと今回明らかになったCapZの分子モデルを示す。アクチンフィラメント末端のアクチン分子をそれぞれ青とピンクで表示している。またCapZのアクチン結合部位である「腕」を赤で表示している。右図はアクチンフィラメントに結合するCapZの結合モデル図である。CapZは現在の結晶構造の位置からその両腕を動かし、アクチンフィラメントへの結合を可能にしていると予想される。(モデルは仮想図である。)
<補足説明>
- ※1 アクチン・ダイナミックス
アクチンは細胞中に最も多量に含まれているタンパク質の1つであり、進化の過程で最もよく保存されているタンパク質でもある。つまり、多数の重要な機能を担うために変異することが許されなかったと言える。アクチンは、もともと筋収縮を担うタンパク質として筋肉中に発見された。その後、あらゆる細胞に存在し多くの機能を担うことが分かってきた。アクチンは単量体が数珠つなぎになって多量体(アクチンフィラメント)を形成する。それまでは細胞中にアクチンフィラメントがひっそりと足場のように存在すると考えられていたが、最近になって(1990年代後半)、細胞中ではアクチンフィラメントの形成と崩壊が速い速度でひっきりなしに起こっていること、細胞の速い運動がアクチンフィラメントの形成と崩壊からなる分子運動によって駆動されていることが解明されてきた。この分子運動を「アクチン・ダイナミックス」(M. F. Carlierら、1993年)と称する。CapZを含むキャッピング・プロテイン(CP)は、「アクチン・ダイナミックス」に不可欠なタンパク質の1つである。アクチンフィラメントの数が増えすぎると、一本あたりの伸長速度は遅くなり、その結果、細胞の運動も遅くなる。CapZでアクチンフィラメントの端を塞ぎ、フィラメントの伸長が数少ないフィラメント端でしか起きないようにする。こうして細胞の速い運動が可能になる。
- ※2 多波長異常分散法
X線の波長を変えられる放射光を使って、波長に依存した原子のX線散乱の変化に基づいて解析する方法。これまでは、原子量の大きい金、白金、水銀などでラベルした質のよい結晶が複数種必要だったが、この方法ではただ一つのラベルされた結晶を使った解析が可能になる。ただしこれによって測定できる信号は微少なため、これまでの方法よりも数段も精度の高い測定が必要となる。
- ※3 Å(オングストローム)
一般的には長さの単位を示す。1オングストロームは1 ×10-10メートル(= 0.1ナノメートル)。X線結晶構造解析においては、高次構造の解像度を示す単位として用いられる。数字が小さいほどより高解像度の立体構造であることを示す。
- ※4 X線回折強度データ
結晶などにX線を照射して測定されるデータ。このデータをもとに結晶内に含まれる分子の立体構造を決定できる。
- ※5 疎水性
水分子との親和性の低い(なじみにくい)性質。逆に水分子との親和性の高い(なじみやすい)性質を親水性という。タンパク質を構成するアミノ酸には疎水性の性質を持つもの、親水性の性質を持つものそれぞれが存在し、タンパク質分子中において疎水性(または親水性)の残基が部分的にまとまって疎水性部分(または親水性部分)を形成していることがしばしば見られる。
|
問い合わせ先: (報道担当) |
- 現在の記事
- 細胞運動を制御する分子メカニズムの一端を解明(プレスリリース)