ヘモグロビンへの配位子結合過程を直接観測(プレスリリース)
- 公開日
- 2003年06月10日
- BL44B2(理研 物質科学)
平成15年6月10日
理化学研究所
|
理化学研究所は、横浜市立大学、自治医科大学と共同で、血液中の酸素運搬タンパク質であるヘモグロビンに配位子が結合する過程を直接観測することに世界で初めて成功しました。理研播磨研究所生体物理化学研究室の足立伸一先任研究員、城宜嗣主任研究員、横浜市立大学の朴三用助教授、Jeremy Tame教授、自治医科大学の柴山修哉講師の研究グループによる成果です。 (論文) |
1.背 景
肺において空気中から体内に取り込まれた酸素は、赤血球中にあるヘモグロビンに結合し、血管を通って体内の各組織へと運ばれます。この際に、ヘモグロビンは単に酸素を着脱するだけではなく、酸素濃度の高い肺では酸素親和性を高くして、より多くの酸素を結合させ、逆に酸素濃度の低い末端組織では酸素親和性を低くして、組織により多くの酸素を与えることができます。このようなヘモグロビンの酸素結合における酸素親和性調節の現象はアロステリック効果※1による協同性※2のモデルとして、古くから多くの研究者の研究対象となってきました。1960年代のMax PerutzらによるX線結晶構造解析研究から、ヘモグロビンは酸素結合型(relaxed型またはR型)と酸素解離型(tense型またはT型)の2つの4次構造をとることが明らかとなり、酸素結合が「引き金」となってR型とT型の間を構造転移するというtriggerモデルが提唱されました。しかし、R型でなぜ酸素親和性が高く、逆にT型で酸素親和性が低くなるのかという最も基本的な問題については、これまで明確な答えが得られていませんでした。
2.研究手法と成果
ヘモグロビンはα、βという構造の類似した2種類のサブユニットそれぞれ2つずつが組み合わさって構成されるα2β2タイプの4量体タンパク質です。それぞれのサブユニットはヘム※3と呼ばれる鉄含有補欠分子を含み、全体として4個の配位子分子を結合させることができます。研究グループは、配位子として酸素の代わりに酸素と同様な構造を持ち、より取り扱いの簡単な一酸化炭素(CO)分子を用いました。そして、ヘモグロビンに4つのCOが結合したR型ヘモグロビン結晶と、COが4つのサブユニットのうちの2つにだけ結合したT型ヘモグロビン結晶を作成しました。T型結晶については、COを2個だけ結合させるために、ヘモグロビンに含まれる4個の鉄のうち、α、βどちらかのサブユニットに含まれる2個の鉄をニッケルに置換することにより、このような状態の結晶を作成しています。これらの結晶を用いて大型放射光施設(SPring-8)の理研構造生物学IIビームラインBL44B2を用いてX線回折データ測定を行いました。この測定では、結晶を25K程度の極低温に保持し、結晶に連続的に可視レーザー光を照射することによりヘモグロビンに結合したCOを解離させ、擬似的にヘモグロビンにCOが結合する直前の準安定状態を比較的長時間安定に作り出すことに成功しました。この準安定状態を保ったまま、1.45Å※4分解能程度のX線回折強度データを得て、RおよびT型ヘモグロビンのCOが光解離した準安定状態の構造を決定することができました。
解明された構造から、光照射によって鉄から解離したCOは、タンパク質内部の鉄周辺の疎水的なポケット内で捕捉された状態でとどまっており、この実験によって、まさにヘモグロビンにCOが結合する直前の準安定状態が作り出されていることがわかりました。CO光解離によるヘモグロビン内部での構造変化をより詳細に見てみると、T型ヘモグロビンでは、R型に比較してCO結合位置周辺により大きな構造歪みが蓄積されていることが明らかとなり、これらの構造歪みがT型ヘモグロビンの低酸素親和性の原因であることをはじめて直接的に証明することができました。さらに、同じT型でもαサブユニットとβサブユニットでは、構造歪みの蓄積されている場所がまったく異なり、αサブユニットではその歪みがタンパク質の軸配位子方向に伝達されてゆくのに対して、βサブユニットでは、配位子とその周辺の側鎖が立体障害を起こす方向に歪みが蓄積していることを明瞭に示すことができました。
3.今後の展開
ヘモグロビンに限らず、生体内のすべてのタンパク質はその機能を発現するために「動き」を伴っています。この機能発現のための構造変化に迫るためには、単に通常の静的構造のX線結晶構造解析のアプローチだけでは困難であり、この研究のような機能発現に連携した動的構造解析が必須です。構造ゲノム科学の発展で多くのタンパク質の静的構造が解析されつつある今日、タンパク質の機能発現機構を包括的に理解するためには、このようなアプローチが今後ますます重要になると考えられます。
また、この研究では、ヘモグロビンへの配位子結合における準安定状態を極低温で「凍結」することにより、配位子結合過程の一断面を詳細に検討することが可能になりました。しかし、本来の配位子結合反応は、タンパク質構造の時間変化を伴ったよりダイナミックなものであるはずです。このようなタンパク質構造のダイナミクスに迫るためには、放射光の単パルスX線を利用した時間分解ポンププローブX線回折実験※5や、他の時間分解分光法などを組み合わせた実験をさらに進めてゆく必要があります。
《参考資料》
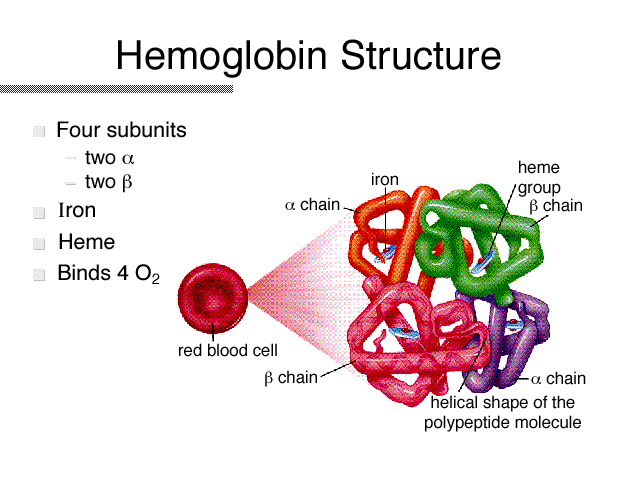
各サブユニットは1個のヘムを含み、中心の鉄に酸素が可逆的に結合する。
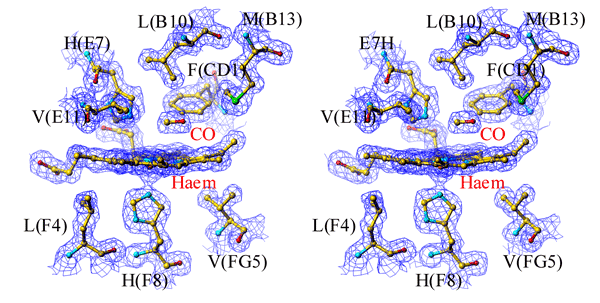
光照射によって鉄から解離したCOは、タンパク質内部の鉄周辺の疎水的なポケット内で捕捉された状態でとどまっており、ヘモグロビンにCOが結合する直前の準安定状態が作り出されていることがわかる。
(*)ステレオ図:左の図を左目で、右の図を右目で、それぞれ別々に同時に見ると立体的に見えます。
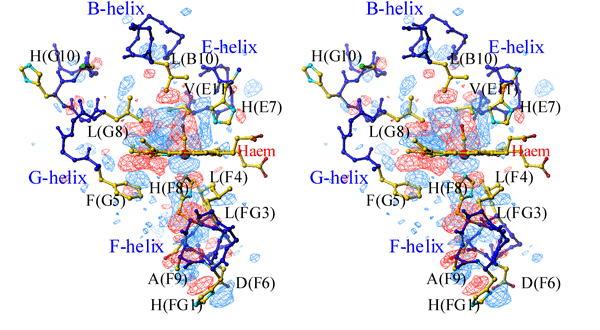
赤の電子密度が光解離前、青の電子密度が光解離後の構造を反映している。光照射によってCOが鉄から解離したことにより、CO周辺と、鉄に直接結合している軸配位子アミノ酸(His(F8))の方向への構造変化が起こっていることがわかる。
(*)ステレオ図:左の図を左目で、右の図を右目で、それぞれ別々に同時に見ると立体的に見えます。
<補足説明>
- ※1 アロステリック効果
酵素の基質結合部位と「立体構造上異なる部位」(allosteric site)に低分子のリガンドが結合してその活性が変化する現象をJ. Monodら(1963)がアロステリック効果と名づけた。その後、一つの酵素またはタンパク質に同一の基質(またはリガンド)が複数個結合しその結合(または酵素活性)に協同性※2が見られる場合にも、この現象をアロステリック効果と呼ぶようになった。ヘモグロビンの場合は、後者の意味で用いられる。
- ※2 協同性
酵素活性やリガンド結合の変化が漸進的、段階的に起こらず、一挙に協調的に起こること。アロステリック効果を示すタンパク質では、サブユニットの一つにリガンドが結合すると、そのサブユニットは立体構造の変化を引き起こし、それにより他のサブユニット間との相互作用が変化し、それらの結合部位のリガンドへの親和性が変化する現象のこと。
- ※3 ヘム(heme または heam)
ポルフィリン鉄錯体の総称。赤血球のヘモグロビンや筋肉中のミオグロビンの成分となって、体の各器官に酸素を運んだり、酸素を貯蔵したりするほか、生体の物質・エネルギー代謝、恒常性維持など多くの重要な生理反応に関与している。
- ※4 Å(オングストローム)
一般的には長さの単位を示す。1オングストロームは1X10-10メートル(= 0.1ナノメートル)。X線結晶構造解析においては、高次構造の解像度を示す単位として用いられる。数字が小さいほどより高解像度の立体構造であることを示す。
- ※5 時間分解ポンププローブX線回折実験
シンクロトロン放射光のパルス性を利用して、パルスレーザー光(ポンプ光)とパルスX線(プローブ光)を組み合わせたX線回折測定法。放射光パルスX線は100ピコ秒程度の時間幅をもつため、光誘起構造転移の動的構造解析法として注目されている。
|
<問い合わせ先> 研究推進部 (報道担当) |
- 現在の記事
- ヘモグロビンへの配位子結合過程を直接観測(プレスリリース)