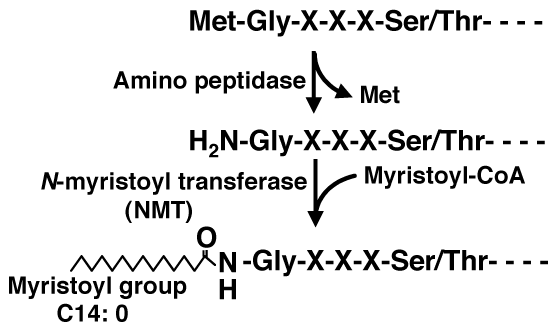脂質修飾によるタンパク質間の認識機能を初めて解明- タンパク質のトンネルを脂質がくぐる複雑な分子構造を解読 -(プレスリリース)
- 公開日
- 2004年02月12日
- BL45XU(理研 構造生物学I)
平成16年2月12日
独立行政法人理化学研究所
|
独立行政法人理化学研究所(野依良治理事長)は、カルナバイオサイエンス株式会社(吉野公一郎代表取締役社長)と共同で、タンパク質の脂質修飾の一つであるミリスチル化がタンパク質間相互作用に直接関わることを、分子レベルで初めて解明しました。理化学研究所播磨研究所メンブレンダイナミクス研究グループの松原守研究員(現:カルナバイオサイエンス株式会社プロテオミクス室長)、中津亨研究員(京都大学大学院薬学研究科助教授)、加藤博章チームリーダー(京都大学大学院薬学研究科教授)、谷口寿章チームリーダー(徳島大学分子酵素学研究センター教授)らによる成果です。 【論文】 |
1.背 景
今日までに100以上のミリスチル化タンパク質が報告されています。特にその中でも、細胞内シグナル伝達系に関わるタンパク質やがん遺伝子産物、ウイルス構成タンパク質に多く見つけ出され、これらタンパク質の機能発現にミリスチル化は必須です。
例えば、がん遺伝子産物であるpp60v-srcチロシンキナーゼ※2では、ミリスチル化がこのタンパク質の重要な機能である癌転移活性に必要不可欠であることが知られており、HIV※3の構成タンパク質であるGagタンパク質のミリスチル化は、HIVの感染に重要であることが示されています。
最も重要であると考えられているミリスチル化の生理的な役割は、タンパク質と細胞膜との結合であり、多くのミリスチル化タンパク質は、ミリスチル基を介して細胞膜に結合することにより、その機能を発揮しています。また、細胞膜との結合は、ミリスチル基の中間的な疎水性※4によって、疎水性の環境である細胞膜と水溶性の環境である細胞質を行き来できる可逆性があることも知られています。
ミリスチル化が主にタンパク質と細胞膜との結合に重要な役割を果たしていること以外、タンパク質間相互作用におけるミリスチル化の役割はこれまでほとんど解明されていませんでした。
2.研究手法と成果
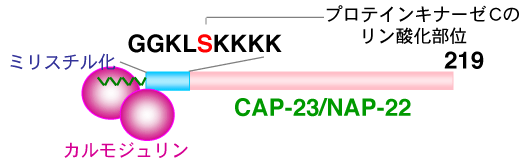
研究チームは、タンパク質間相互作用にミリスチル化が直接関わる現象を、神経軸策突起※5の先端部(成長円錐※6)に多く存在し、神経軸策突起の再生に重要であると考えられているCAP-23/NAP22とその生理的ターゲット因子であるカルモジュリンとの結合で明らかにしました。
これまでの結果から、ミリスチル化されたCAP-23/NAP-22とカルモジュリンの結合は、CAP-23/NAP-22のミリスチル化部分を含むN末端の9アミノ酸残基(myr-GGKLSKKKK)であることが分かっていました。このミリスチル化ペプチド(myr-GGKLSKKKK)とカルモジュリンとの結晶化を行い、複合体の結晶を単離しました。この複合体の結晶を、大型放射光施設SPring-8の理研構造生物学ビームラインを用いてX線回折データを収集し、その結果を基に複合体の立体構造を2.3Å※7の分解能で決定しました。
複合体の立体構造から、以下のようなミリスチル化が直接関与するタンパク質間相互作用の分子機構が明らかとなりました。
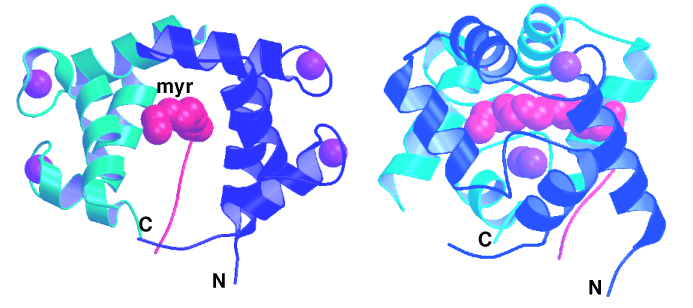
(1)CAP-23/NAP-22のミリスチル基は、カルモジュリンのN末端ドメインとC末端ドメインによって形成される疎水性のトンネル構造の中央を貫通しているという非常にユニークな分子認識をしていることが明らかとなりました。ミリスチル基と相互作用を持つカルモジュリン残基のほとんどは疎水性残基であることから、タンパク質ミリスチル化による分子認識は主に疎水性相互作用で行われていることが証明されました。
(2)ミリスチル基以外にもCAP-23/NAP-22のアミノ酸残基が深く関わっており、3番目のリジンと4番目のロイシンが特に重要でありました。また、連続した4個のリジン残基もカルモジュリンの酸性残基との相互作用に関与していることが示唆されました。これらの結果は、これまで研究チームが示してきた生化学データと一致するものでした。
(3)従来のカルモジュリンと標的ペプチドとの複合体構造においては、標的ペプチドはαへリックス構造をとること、ペプチドの特定の場所に疎水性の残基が存在して、カルモジュリンのN末端ドメインとC末端ドメインに存在する疎水性のポケットにこれらの残基がはまり込むということが重要でした。しかし、今回の複合体の構造では、ミリスチル化ペプチドはαへリックス構造をとるのではなく、ミリスチル化の部分が従来のペプチドのαへリックス構造の部分を補っていました。また、2つの疎水性ポケットにはまり込むような疎水性残基は全くなく、これまでのカルモジュリンの標的認識機構に当てはまらない新規なものであることがわかりました。
3.今後の展開
これまで、ミリスチル化はタンパク質と細胞膜との相互作用に重要であるとされてきましたが、今回明らかにしたミリスチル化によるタンパク質間相互作用の分子レベルでの解明は、ミリスチル化タンパク質の細胞内シグナル伝達系における役割に新たな道を開いたものといえます。研究チームは、今回示したCAP-23/NAP-22以外にもプロテインキナーゼCの基質タンパク質であるMARCKS※8やHIVの構成タンパク質であるNef※9のN末端のミリスチル化ドメインもカルモジュリンとの相互作用に不可欠であることを証明しており、タンパク質間相互作用におけるミリスチル化の役割は普遍的である可能性があります。また、これらのタンパク質は、ラフト※10と呼ばれる細胞内シグナル伝達因子が集積している細胞膜ドメインに存在していることからも、ラフト中でのタンパク質間相互作用にミリスチル化が重要な役割を担っていると考えられます。更に、ミリスチル化タンパク質の多くは、がんやウイルス感染に深く関わっていることから、本研究で得られたミリスチル化による新規な分子認識機構は、がんやウイルス感染に対する新たな治療薬の設計にも大きく寄与するものと期待されます。
<参考資料>
ミリスチル化タンパク質は、N末端にMet-Gly-X-X-X-Ser/Thr (Xは任意のアミノ酸)というコンセンサス配列を持ち、翻訳中に開始Metが切断除去されます。この構造がN-ミリスチル転移酵素(NMT)によって認識され、新たにN末端に露出したGlyのアミノ基にミリスチルCoAから炭素数14の飽和脂肪酸であるミリスチン酸が転移します。
CAP-23 (cortical cytoskeleton-associated protein of 23 kDa) /NAP-22 (neuron-specific acidic protein of 22 kDa)は、約220アミノ酸残基の神経特異的タンパク質です。MARCKSファミリータンパク質の一つで、プロテインキナーゼC (PKC)の基質タンパク質で、5番目のSerがリン酸化されます。ラフトという細胞膜ドメインに存在し、コレステロールやPIP2などの脂質とも結合します。また、ミリスチル化依存的にカルモジュリンと結合します。主に、神経軸策突起の成長円錐に存在し、神経軸策突起の再生に深く関わっていると考えられています。
左側は、正面から、右側は90度回転した面からみたもの。CAP-23/NAP-22のミリスチル化ドメインを赤色(マゼンタ)で、カルモジュリンのN末端ドメインを水色、C末端ドメインを青色で示しています。
CAP-23/NAP-22のミリスチル化部分は、カルモジュリンのN末端ドメインとC末端ドメインで囲まれた中央の部分を貫通しています。ミリスチル化に続くアミノ酸部分はGlyの部分で90度折れ曲がってカルモジュリンの外側の方向へ伸びています。
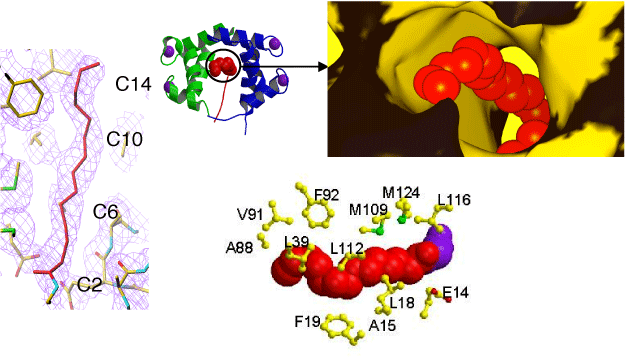
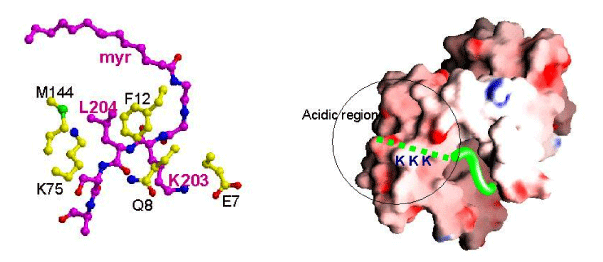
CAP-23/NAP-22のミリスチル化部分の電子密度mapがはっきりと見えています(左図)。拡大した図(右上図)から、カルモジュリンの疎水性残基(黄色の部分)で形成されたトンネルの中央をまっすぐに貫通していることが分かります。また、ミリスチル基から5Å以内に存在するカルモジュリンの残基のほとんどは、疎水性残基であることが分かります(右下図)。
CAP-23/NAP-22のミリスチル化に続くアミノ酸部分とカルモジュリンの結合を詳しく見ると、Leu204がカルモジュリンのPhe12とMet144と疎水性相互作用を、Lys204とカルモジュリンのGlu7が静電的な相互作用をして両者の複合体の構造を安定化しています(左図)。また、連続するLys(今回の結晶構造解析では電子密度mapは確認できませんでした)の存在する方向に、カルモジュリンの酸性領域があることから、相互作用をしていると考えられます(右図)。
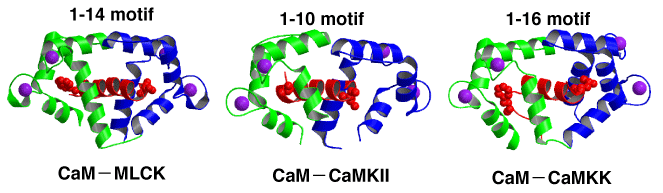
従来のカルモジュリンと標的ペプチドの複合体構造においては、標的ペプチドは必ずαへリックス構造をとっています。また、ペプチドの特定の位置に疎水性の残基が存在して、カルモジュリンのN末端ドメインとC末端ドメインに存在する疎水性のポケットにこれらの残基がはまり込むようになっています。例えば、ミオシン軽鎖キナーゼ(MLCK)では、14個離れたところに疎水性の残基が存在しています。10個離れているカルモジュリンキナーゼII(CaMKII)や16個離れているカルモジュリンキナーゼキナーゼ(CaMKK)など様々なモチーフがあります
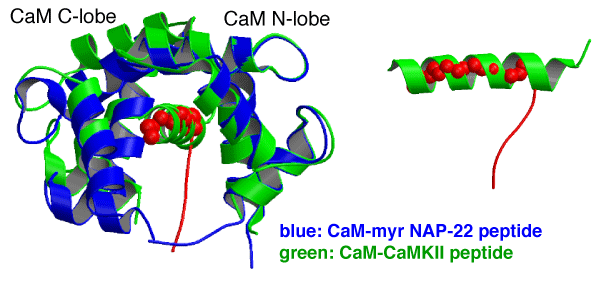
両者の複合体構造を重ね合わせると、CaMKIIペプチドのαへリックス部分にCAP-23/NAP-22のミリスチル化部分が対応していることが分かります。ミリスチル基以外の部分は、90度折れ曲がって、カルモジュリンの外側の方向に伸びています。この部分はCaMKIIペプチドに全く当てはまっていないことも分かります。このように、従来のカルモジュリンの分子認識とは異なる新規な分子認識をしていることが明らかとなりました。
<用語解説>
- ※1 カルモジュリン
真核生物にひろく存在する148アミノ酸残基からなる細胞内カルシウム結合タンパク質。カルシウム結合タンパク質に特有なEFハンド構造をもっている。数多くのタンパク質に結合することにより広範な生理機能を示す。
- ※2 pp60v-srcチロシンキナーゼ
ラウストリ肉腫ウイルス由来の遺伝子(v-src)がコードする分子量6万のタンパク質で線維芽細胞の癌化の開始と維持に関与する。タンパク質中のチロシンをリン酸化するチロシンキナーゼである。これに対応するタンパク質が正常の細胞に存在し、pp60c-srcと呼ばれる。
- ※3 HIV
ヒト免疫不全ウイルス(human immunodeficiency virus)の略。エイズウイルスともいい、後天性免疫不全症候群(エイズ)の原因レトロウイルスである。レトロウイルスに基本的なgag, pol, env遺伝子のほか、tat, rev, nef, vip, vprなどの遺伝子も含む。
- ※4 疎水性
水分子との親和性が低い性質。逆に、水分子と親和性の高い性質を親水性という。疎水性アミノ酸の間の相互作用(疎水結合)によりタンパク質の立体構造を支えている。またタンパク質の表面の疎水性領域は、他のタンパク質と結合している部分か、細胞膜の脂質部分に接している部分であると考えられる。
- ※5 神経軸策突起
神経細胞から伸びる細長い突起で、電気的情報を遠隔部位に存在する他の神経細胞や筋肉細胞などに伝える。複雑かつ精巧に張り巡らされた神経軸索突起のネットワークが、脳神経系の働きの中心的役割を担っている。
- ※6 成長円錐
神経発生・再生過程において、伸長している軸索突起の先端部に形成される手のひらの形をした領域をいう。
- ※7 Å(オングストローム)
長さの単位で、1オングストロームは1x10−10メートル(=0.1ナノメートル)。
タンパク質の立体構造解析においては、解析した構造の分解能を表す単位として用いられ、数字が小さいほどより精度の高い高解像度の立体構造であることを示す。
- ※8 MARCKS
myristoylated alanine-rich C kinase substrateの略で、プロテインキナーゼCの代表的な基質タンパク質。N末端のミリスチル化ドメインと分子中央部のエフェクタードメインと呼ばれるプロテインキナーゼCのリン酸化ドメインで細胞膜と結合する。ミリスチル化—リン酸化スイッチ機構で可逆的に細胞膜と結合する。エフェクタードメインでカルモジュリンやアクチンとも結合する。
- ※9 Nef
HIVのアクセサリータンパク質の一つで約200アミノ酸残基からなる。HIV感染の初期に働き、CD4のダウンレギュレーションなどを引き起こす。宿主細胞内の多くのシグナル伝達タンパク質と結合する性質ももつ。
- ※10 ラフト
ラフトとは筏(いかだ)の意味。細胞膜上にスフィンゴ脂質やコレステロールを主成分とする動的な細胞膜ドメインが筏(いかだ)のように存在し、細胞内シグナル伝達分子が集まり効率よくシグナルを伝えることができるようになっていると考えられている。
|
<本件に関する問い合わせ先> カルナバイオサイエンス株式会社 独立行政法人理化学研究所 播磨研究所 (報道担当) <SPring-8についての問い合わせ先> |
- 現在の記事
- 脂質修飾によるタンパク質間の認識機能を初めて解明- タンパク質のトンネルを脂質がくぐる複雑な分子構造を解読 -(プレスリリース)