光合成の酸素発生に関わるタンパク質の構造を解明- 光合成植物の進化に新たな知見 - (プレスリリース)
- 公開日
- 2004年03月12日
- BL44B2(理研 物質科学)
- BL45XU(理研 構造生物学I)
平成16年3月12日
独立行政法人理化学研究所
|
独立行政法人理化学研究所(野依良治理事長)は、京都大学と共同で、酸素を生み出す植物の光合成に関わるタンパク質(PsbP:ピー・エス・ビー・ピー)の立体構造を、大型放射光施設(SPring-8)の理研構造生物学IIビームラインBL44B2および理研構造生物学IビームラインBL45XUを用いて世界で初めて解明しました。この研究成果は、理研播磨研究所メンブレンダイナミクス研究グループの伊福健太郎研究員(京大大学院生命科学研究科助手)、中津亨研究員(京大大学院薬学研究科助教授)、加藤博章チームリーダー(京大大学院薬学研究科教授)、京大大学院生命科学研究科の佐藤文彦教授らの研究グループによる成果です。 (論文) |
1.背 景
「光合成」は一般的には「植物が太陽光を利用して二酸化炭素を吸収し、糖に変換すると同時に酸素を発生する反応」として理解されています。厳密にはこれを「酸素発生型光合成」と呼びますが、もう少し詳しくみると、その最初のステップは太陽エネルギーを利用して水分子を分解し、酸素と水素イオン、そして二酸化炭素の還元に必要な電子を取り出す反応から始まります。この反応を行うのが、植物の場合、葉緑体という細胞内小器官に存在する光化学系※1IIと呼ばれるタンパク質複合体です。
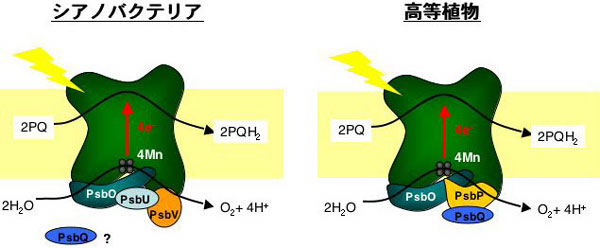
酸素発生型光合成を行う生物には高等植物だけでなく、コケや緑藻、さらには原核生物※2であるシアノバクテリアも含まれます。このうちシアノバクテリアは、太古の時代に真核生物※2のなかに取り込まれて葉緑体の起源となった生物に近いと考えられている光合成を行う細菌です。従って、光化学系II複合体を構成するタンパク質もシアノバクテリアから高等植物にいたるまで基本的にはよく保存されています。ところが、実際に水分解-酸素発生反応が起る反応中心の周辺にあるタンパク質に関しては、高等植物・緑藻はシアノバクテリアと異なるタンパク質を持っています(図1)。即ち、シアノバクテリアではPsb※3V、PsbUと呼ばれるタンパク質が高等植物・緑藻ではPsbP、PsbQに置き換わっているのです。これらのタンパク質はいずれも水分解-酸素発生反応を最適化するのに必要なのですが、おそらくは進化の過程において、その生育環境にあわせて変化したのだと考えられています。しかしながら、その理由に関しては長らく謎とされてきました。
2.研究手法と成果
- 2-1.研究手法
高等植物・緑藻が新たに獲得したPsbP、PsbQの内、PsbQに関してはシアノバクテリアの光化学IIから似たタンパク質がみつかり、その由来が次第に明らかになりつつあります。一方でPsbPに関してはそうした報告は今のところありません。最近、シアノバクテリアのゲノム※4中にPsbPと少し似たタンパク質を作る遺伝子が存在することが明らかになりましたが、今のところ光化学IIを構成するタンパク質である証拠はなく、生物における役割も全くわかっていませんでした。
そこで研究チームは、PsbPの立体構造からその由来や機能が解明できないかと考えました。X線結晶構造解析を用いて立体構造を決定する為にはタンパク質を高純度に精製し、結晶化する必要があります。これまで複数のグループがPsbPの構造決定に挑戦してきましたが、いずれも成功しませんでした。そこで私達は複数の植物から7種類のpsbP遺伝子を集め、各々のPsbPを大腸菌で作らせて精製し、良い結晶が得られるものを探しました。その結果、タバコに由来するPsbPの一つがX線結晶構造解析に適していることが判明しました。それでも結晶は不安定であったため、SPring-8の高性能なX線を用いて多波長異常分散法※5が利用できた事が構造決定成功の鍵となりました。
- 2-2.立体構造の解析結果から明らかになったこと
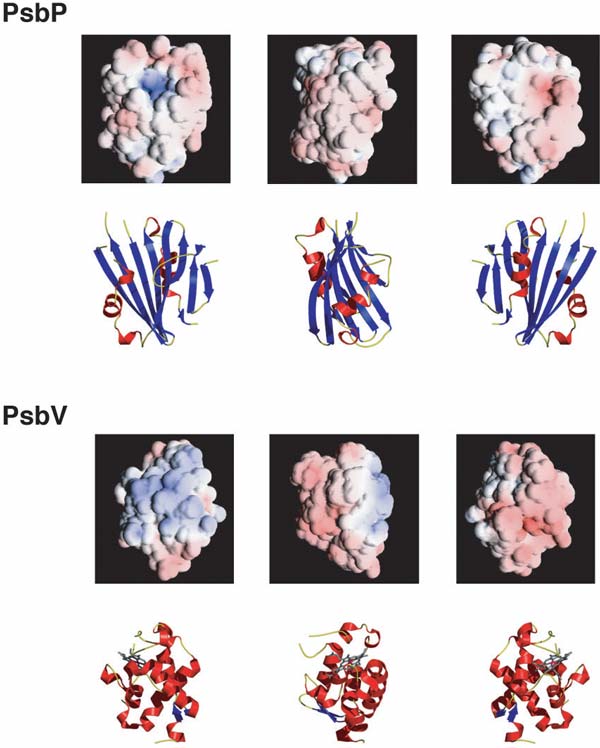
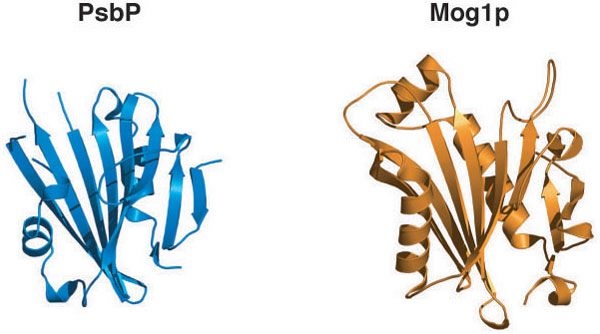
PsbPの構造は1.6Å※6という高分解能の解析で決定できました。その構造は主にβ-シート※7構造を基本に構成されていました。タンパク質の表面電荷の比較から、PsbPとシアノバクテリアのPsbVとの間には似ている部分があり、両者が同様の性質で光化学系IIに結合している事が示唆されました。しかし、両者の立体構造は全く異なっており、PsbPと類似した構造を持つタンパク質はシアノバクテリアの光化学系IIにはやはり存在しませんでした(図2)。この事は高等植物や緑藻が、光化学系II の構成タンパク質として立体構造的にも全く新規なタンパク質を獲得した事を示しています。また驚いた事にPsbPの立体構造は、Ran-GTPaseとの結合タンパク質であるMog1pとそっくりなことが判明しました(図3)。Ran-GTPaseは、結合しているGTP※8の加水分解を通して、細胞核へのタンパク質の輸送や細胞分裂の制御等にも関わる重要な酵素であり、真核生物に普遍的に存在しています。Mog1pは、そのRan-GTPaseがGTPと結合した活性化された状態に保つのに重要な役割を果たしています。
最近、高等植物の光化学系IIにおいては、その反応で中心的な役割を果たすD1タンパク質の分解-再合成過程※9にGTPが重要な役割を持つ事が報告され、しかも光化学系IIにおいてPsbPと直接相互作用していると考えられているPsbOタンパク質にそのGTPが結合している事が報告されました。一方でシアノバクテリアではそうした報告は今のところありません。私達が示したPsbPの構造は、PsbPがMog1pと同じ様な役割を高等植物の光化学系IIにおいて果たしている可能性を示唆しています。
3.今後の展開
PsbP分子自体の発見は1980年代になされていましたが、これまで長らくその分子研究はあまり進展がありませんでした。今回の構造解析によって植物科学と光合成研究において新たな研究展開が生じるでしょう。現在、私達もPsbPとGTPとの関わりについて生化学的な解析を進めています。またPsbPの立体構造をもとに、シアノバクテリアなどに存在するPsbPと少し似たタンパク質群(PsbPの祖先?)の解析が進み、PsbPの分子進化の全容が明らかになる事が期待されます。これによって原核生物から真核生物にいたる酸素発生型光合成植物の進化の大きな流れの一つが解明できるでしょう。
一方で、PsbPが進化の過程で生育環境変化に対応して獲得されたのであれば、逆にPsbPを利用して、様々な生育環境にあわせて植物の光化学系II活性を遺伝子工学的に改変できるかもしれません。実際に塩害や低温といった様々な環境ストレス要因によるPsbPのタンパク質量の変化、もしくはPsbPタンパク質のリン酸化※10が報告されるなど、この分子の生物における役割に関してもまだまだ解明すべき点が多く残されています。今回得たPsbPの立体構造はこうした研究にも間違いなく役に立つと期待できます。
<参考資料>
光化学系II複合体は光エネルギーを利用して水分子を酸素、水素原子、そして電子に分解する。取り出された電子は、プラストキノン(PQ)と呼ばれる分子を還元し(PQH2)、次のステップへと運ばれる。水分解-酸素発生反応を直接触媒するのは4分子のマンガン原子(Mn)である。その周辺には酸素発生系と呼ばれる膜表在型のタンパク質が存在するが、その構成タンパク質がシアノバクテリア(PsbO, PsbV, PsbU, PsbQ?)と高等植物(PsbO, PsbP, PsbQ)では異なっている。PsbQに関しては、シアノバクテリアの光化学系IIにPsbQと似たタンパク質が存在するとの報告があるが、どこに結合しているかは明らかではない。
PsbPとPsbV分子の表面は、正に荷電した領域(青色)と反対側の負に荷電した領域(赤色)が明確に存在し、その点では共通性がある。しかしながら、両者は立体構造上は全く異なる。
<用語解説>
- ※1 光化学系
光エネルギーを用いて化学反応を行う反応系のこと。酸素発生型光合成には光化学系Iと光化学系IIと呼ばれる二つの光化学系が存在している。光化学系IIが水分子を分解して電子を取り出し、酸素と水素イオンを放出する反応を行うのに対し、光化学系Iは、光化学系IIからの電子を受け取って、二酸化炭素の還元に必要な強い還元力(NADPHという化合物)の形成を行う。
- ※2 原核生物と真核生物
原核生物は細胞に核を持たない生物で、細菌(真正細菌、バクテリア)、古細菌(アーキア)などが含まれる。逆に真核生物は細胞に核を持つ生物で、動物、植物、カビ、原生動物など。
- ※3 Psb(ピー・エス・ビー)タンパク質
光化学系II複合体を構成するタンパク質群のこと。各々のタンパク質はPsbA〜 PsbZの様にアルファベットをつけて区別されている。Psは光化学系 (photosystem)の略で、bはIIに由来する。
- ※4 ゲノム
ある生物がその生物として生き,子孫を残すのに最低限必要な遺伝情報の1セット(遺伝子群)のことをさす言葉。ヒトのゲノムは長さ2m,約30億塩基対で構成されている。ショウジョウバエでは長さ1cm,約1億7000万塩基対,また大腸菌では長さ1mm,約470万塩基対である。このように,生物種ごとに固有のゲノムがある。
- ※5 多波長異常分散法
X線結晶構造解析法の一つ。一連の金属原子のX線散乱能は波長に強く依存することを利用してタンパク質結晶構造を決定する。従来の方法では、構造決定のためには複数種の重金属原子(原子量の大きい金、白金、水銀など)を結合したタンパク質の結晶が必要だったが、この方法ではただ一種の金属原子を結合した結晶を用意すれば解析が可能になる。ただしこの方法では、波長可変のX線を使う必要があること、信号が微弱なため従来よりも輝度の高いX線源が必要でありかつ精度の高い測定が必要となる。以上の理由から、この方法はSPring-8のような放射光実験施設を使ってはじめて可能になった。この方法は最近5年間盛んに用いられるようになった。
- ※6 Å(オングストローム)
長さの単位で、1オングストロームは1x10-10メートル(= 0.1ナノメートル)。タンパク質の立体構造解析においては、解析した構造の分解能を表す単位として用いられ、数字が小さいほどより精度の高い高解像度の立体構造であることを示す。
- ※7 β-シート
α-へリックスと並んで、タンパク質のアミノ酸鎖がとる堅固な構造の一つ。こうしたα-へリックス、β-シートなどは二次構造と呼ばれ、タンパク質の立体構造を構成する基本構造である。
- ※8 GTP
グアノシン三リン酸のこと。GTPは酵素の働きでGDP(グアノシン二リン酸)と無機リン酸に加水分解される。生体内のGTP (GDP)を結合するタンパク質の中には、GTP結合型とGDP結合型で立体構造が変わることにより機能の調節を受けているものが多数存在する。
- ※9 D1タンパク質の分解-再合成過程
光化学系 II 反応中心タンパク質 D1 は、他のタンパク質と比べて非常に早い分解-再合成のサイクルを示す。これはD1タンパク質が、太陽エネルギーという強いエネルギーを利用して、水分解という困難な起こす場所であるが故に、常にダメージを受けやすいためである。よって光合成生物では、その分解-再合成過程がスムーズにいくことが非常に重要なのだが、そのしくみには未だ不明な点が多く、現在も多くの植物科学者が研究している。
- ※10 タンパク質のリン酸化
生体内のタンパク質は、酵素の働きでリン酸化されることにより、その機能が変化するものがある。すなわち、リン酸基による修飾の有無によって、非常にたくさんの重要なタンパク質の働きが調節されている。
|
<本件に関する問い合わせ先> 京都大学大学院 生命科学研究科 独立行政法人理化学研究所 播磨研究所 (報道担当) <SPring-8についての問い合わせ先> |
- 現在の記事
- 光合成の酸素発生に関わるタンパク質の構造を解明- 光合成植物の進化に新たな知見 - (プレスリリース)