史上最高の熱安定性を持つタンパク質を発見 - “かたち”が生みだす約150℃の熱安定性 -(プレスリリース)
- 公開日
- 2006年07月13日
- BL44B2(理研 物質科学)
平成18年7月13日
独立行政法人理化学研究所
本研究成果のポイント
○ 既知タンパク質より30℃高い、約150℃まで熱安定なタンパク質を発見
○ 分子表面一面に覆われたイオン結合から生まれる高い熱安定性
○ プリオンなど生体内で異常に安定なタンパク質の働きの解明などに貢献
|
独立行政法人理化学研究所(野依良治理事長)は、約150℃という史上最高の熱安定性を持ったタンパク質を発見し、その安定性がタンパク質分子表面のイオン結合※1にあることを明らかにしました。播磨研究所放射光科学総合研究センターの油谷(ゆたに)克英上級研究員らの研究グループによる成果です。 (論文) |
1. 背 景
生体の主な構成素材であるタンパク質が機能を発揮するためには、その姿かたち、すなわち立体構造がどのようになっているかが重要です。しかし、立体構造は、熱やpHのわずかな変化、変性剤添加など、環境の変化に影響をうける非常に弱いものです。タンパク質の安定性は、微妙なエネルギーバランスで保たれているので、「marginal stability」つまり「差引勘定ぎりぎりの安定性」とも呼ばれています。立体構造を維持する仕組みの解明は、タンパク質のアミノ酸配列から立体構造、さらには機能を予測する上でも重要です。高い温度で生育する好熱菌、超好熱菌由来のタンパク質は、一般に高い安定性を示すため、タンパク質の安定性研究の対象としてよく使われています。しかし、好熱菌、超好熱菌由来のタンパク質であっても、個々のタンパク質で安定化因子は異なり、わずかなエネルギーバランスで保たれている点は他のタンパク質と変わりがありません。通常の生体であれば茹で上がってしまうような過酷な環境で、何故好熱菌が生きられるのか、それを明らかにするためには、タンパク質が何故過酷な環境でも安定なのかを明らかにしなければなりません。しかし、タンパク質の熱安定化機構は多くの説が提案されてきましたが、確固たる説は未だに確立されていませんでした。
2.研究手法
研究グループは二価カチオン※5耐性タンパク質「CutA1(カットエーワン)」に着目しました。このタンパク質は、生体内の銅イオン制御に関わるタンパク質で、バクテリアから動植物にまで広く分布しており、人間の脳細胞にも含まれています。また、タンパク質の安定性を測定するために、示差走査熱量計(Differential Scanning Calorimeter: DSC)を用いました。一般のDSCは120〜130℃までしか測定できませんが、今回、独立行政法人農業生物資源研究所の加藤悦子主任研究員の協力を得て、150℃まで測定可能な装置「VP-DSC/ETR」を用いました。超好熱菌Pyrococcus horikosii (パイロコッカス・ホリコシイ、最適生育温度98℃)、高度好熱菌Thermus thermophilus (サーマス・サーモフィルス、最適生育温度75℃)、常温菌Escherichia coli(エシェリキア・コリ(大腸菌)、最適生育温度37℃)という3種の異なった生育温度をもつ生物のCutA1の立体構造を比較し、熱安定化の原因を調べました。
3.研究成果
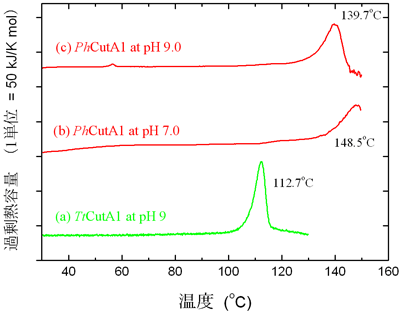
DSC実験を行ったところ、超好熱菌Pyrococcus horikosii 由来のCutA1 「PhCutA1」(超好熱菌由来カットエーワン)は、pH7での変性温度が148.5℃という極めて高い値を示しました(図1)。この温度は、これまで最高の熱安定性を持つタンパク質の変性温度である120℃を約30℃も上回るものです。また、測定条件を色々と変えることによって得た測定後の試料について、熱による破壊の程度をSDS-電気泳動※6と質量分析※7によって調べました。その結果、立体構造が破壊して初めてアミノ酸の熱分解が起こることが分かりました。つまり、タンパク質の立体構造が、構成するアミノ酸残基の熱分解を抑制しながら、それ自身の姿かたちを支えていることを意味しています。
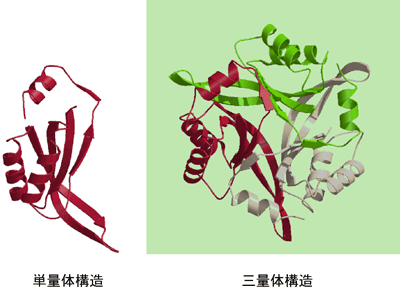
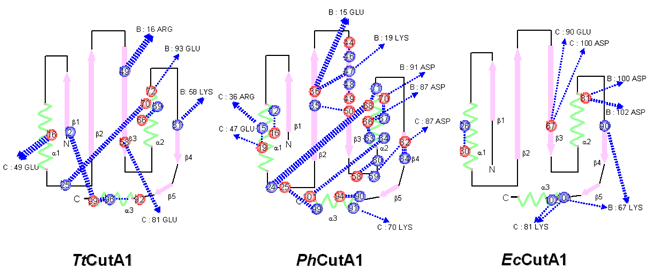
大型放射光施設(SPring-8)の理研構造生物学IIビームラインBL44B2を用いてPhCutA1の立体構造を明らかにしました(図2)。PhCutA1は102残基からなる同一サブユニットの3量体構造で、一つのサブユニットが他の二つのサブユニットと絡み合うように、βシートを互いに共有しています。また、3量体の中心部にβシートが集まり、そのまわりにαへリックスのらせん構造が見られます。PhCutA1の大まかなかたちは、Escherichia coli由来のEcCutA1(常温菌由来カットエーワン)とThermus thermophilus 由来のTtCutA1(高度好熱菌由来カットエーワン)と大変よく似ていました。しかし、単量体構造を比較すると、PhCutA1の水素結合※8、イオン結合、疎水性相互作用はいずれも他の2者よりも強力で、とりわけ、0.5ナノメートル(1ナノ=10億分の1)以内の単量体内のイオン結合数はPhCutA1、TtCutA1、EcCutA1で、それぞれ31本、12本、1本であり、PhCutA1に際だって多くイオン結合が含まれていることが明らかになりました。図3に示すように、この多数のイオン結合は、PhCutA1分子表面一面に広がってイオン結合のネットワークを形成し、あたかもイオン結合の層が断熱材の役割を果たし、異常に高い温度までこのタンパク質のかたちを保護しているかのようです。つまり、この断熱材が150℃近くまで立体構造を安定に保つカギとなっているのです。
4.今後の期待
分子表面を覆うイオン結合層による熱安定化は、個々のタンパク質についても適用できるかどうか検証していく必要があります。これまでにも、分子表面のイオン結合がタンパク質の安定化に寄与するという報告がないわけではありません。しかし、今回のように、150℃までもの熱安定性を持つ蛋白質の発見とその原因の解明は、タンパク質の構造や安定性についての研究に新たな概念を提案しています。さらに、タンパク質の立体構造が、構成アミノ酸残基の熱分解を抑制しているという結果は、熱分解を受けやすいアミノ酸を、より高い温度においても有効利用できることを示すものであります。そして、これらの発見は、かなり高い熱安定性を必要とする蛋白質の設計の基本的な指針を与えるもので、蛋白質工学の発展への重要な貢献が期待できます。
一方、CutA1は、バクテリアにおいて銅イオンと関わるタンパク質であることが知られていますが、機能はまだ明らかになっていません。一般的なタンパク質の立体構造の「もろさ」は、タンパク質のスムーズな代謝回転など、生命活動にとって重要です。アミロイドーシス、アルツハイマー病、プリオン病などは、普通のタンパク質が生体内で壊れない「安定なタンパク質」に変形したことによる病気と言われています。常温生物由来のCutA1であっても、常温生物としては異常に高い100℃近い変性温度示すことを研究チームでは既に明らかにしています。このように、異常に高い熱安定性を持つ蛋白質がほとんど全ての生物に存在することは、この高い安定性がその生物にとって有害であるはずがありません。この蛋白質の熱安定性が生体内でどのような影響を持つのかを明らかにすることで、過酷な環境下でも持続できる生命現象に新しい知見を与えるだけでなく、生物学的・医学的にも重要な、タンパク質異常で安定性が高くなるために生じる病気(アミロイドーシス、アルツハイマー、プリオン病)を解き明かすカギとなるに違いありません。
< 参考資料 >
DSCカーブはタンパク質の変性に伴う熱吸収の量を示す。
(a) pH 7.0でのTtCutAのDSC曲線
(b) pH 7.0でのPhCutA1のDSC曲線
(c) pH 9.0 でのPhCutA1のDSC曲線
らせんと矢印はそれぞれαへリックスとβシートの二次構造を示す。三量体構造は単量体ごとに色付けされている。
各分子の緑色のらせんがαへリックス、ピンクの矢印がβシートを示す。赤丸と青丸はそれぞれ正と負にイオン化するアミノ酸残基を示し、数字は残基番号。青の1本の点線が1本のイオン対に対応する。幅はイオン結合の数を示す。
<用語解説>
※1 イオン結合
物質間に働く静電気的な相互作用で、塩結合とも呼ばれる。タンパク質の場合、正に荷電するアミノ酸残基(リシン、アルギニン、ヒスチジン)と負に荷電するアミノ酸残基(グルタミン酸、アスパラギン酸)の間のイオン間相互作用を指す。0.5ナノメートル以内の相互作用が有効であると言われている。
※2 示差走査熱量計
一般にDSC (Differential Scanning Calorimeter)と呼ばれ、試料セルと参照セルを同時に一定速度で昇温させ、試料の構造変化を熱量の出入りから観測する。タンパク質の定量的変性研究に最も信頼されている装置である。
※3 アミノ酸残基
タンパク質はアミノ酸が水分子を失ってペプチド結合を形成して直鎖状に繋がってできている。蛋白質を構成するもともとの個々のアミノ酸部分をアミノ酸残基という。
※4 大型放射光施設(SPring-8)
兵庫県にある大型共同利用施設。ほぼ光速で進む電子が、その進行方向を磁石などによって変えられると接線方向に電磁波が発生する。これが「放射光(シンクロトロン放射)」と呼ばれるものであり、電子のエネルギーが高く進む方向の変化が大きいほど、X線などの短い波長の光を含むようになる。特に第三世代の大型放射光施設と呼ばれるものには、世界にSPring-8、APS(アメリカ)、ESRF(フランス)の3つがある。SPring-8(電子エネルギー:8GeV)の場合、遠赤外から可視光線、真空紫外、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができ、国内外の研究者の共同利用施設として、物質科学・地球科学・生命科学・環境科学・産業利用などの分野で利用されている。
※5 カチオン
正の電気を帯びたイオンのこと。陽イオン。
※6 SDS-電気泳動
電気泳動は、分子が電場 (電界) 中を移動する現象であり、DNAやタンパク質を分離する方法として広く用いられる。DNAや蛋白質などの高分子をドデシル硫酸ナトリウム(SDS)が存在するゲルなどの担体に通して電場をかけると、タンパク質は陽極に向かって移動する。しかし、タンパク質の大きさは多様であり、大きいタンパク質分子ほど担体が障害となって移動速度が低下する。この移動速度の差によってタンパク質を分離できる。
※7 質量分析
原子や分子等を何らかの方法で気体状のイオンとして、それのイオンの質量を分析することにより、原子や分子の種類を推定することができる。また、そのイオンの検出量から、原子や分子の含有量を調べることができる。
※8 水素結合
分子間で水素原子を挟んで電気的な引力が働くときに生じる結合を水素結合という。化合物の沸点、水に対する溶解度などの物性を決める上で重要な働きをしており、その有無で化合物の特性が大きく異なる。
|
<本件に関する問い合わせ先> 独立行政法人理化学研究所播磨研究所 播磨研究推進部 猿木 重文 (報道担当) <SPring-8についての問い合わせ先> (財)高輝度光科学研究センター |
- 現在の記事
- 史上最高の熱安定性を持つタンパク質を発見 - “かたち”が生みだす約150℃の熱安定性 -(プレスリリース)