スルメイカの光センサー蛋白質の立体構造を解明-細胞外の情報を細胞内へと伝える分子スイッチの構造が明らかに-(プレスリリース)
- 公開日
- 2008年05月15日
- BL38B1(構造生物学III)
2008年5月15日
国立大学法人名古屋大学
本研究のポイント
○G蛋白質共役型受容体の細胞膜中で機能を発現する構造を解明
○G蛋白質共役型受容体の出力部位の構造を決定
○ 無脊椎動物の眼が偏光を感知する仕組みを解明
|
名古屋大学大学院理学研究科の神山勉教授・村上緑助教の研究グループは、スルメイカの光センサー蛋白質ロドプシン※1の立体構造を解明することに成功しました。この構造から、ロドプシンに代表されるG蛋白質共役型受容体※2が細胞膜に埋め込まれて機能を発現する構造が初めて明らかとなりました。イカロドプシンの細胞質側に大きく突き出た構造は、細胞内で情報を伝達するGタンパク質※3と結合するために重要であり、さらに、ロドプシンに含まれる色素体の向きから、無脊椎動物の眼が偏光※4を感知する仕組みを説明できることが明らかとなりました。イカロドプシンの結晶構造は、ヒトの様々な疾患に関連するG蛋白質共役型受容体の構造モデルを提供するもので、G蛋白質共役型受容体を標的とした医薬品開発に大きく貢献すると期待されます。本研究の成果は、英国の科学雑誌『Nature』5月15日号に掲載されます。 (論文) |
研究の背景
あらゆる細胞は外部環境の変化に適切に対応します。細胞を包む細胞膜には、外界の様々な情報を感知する受容体と呼ばれるタンパク質が埋め込まれており、細胞外の情報を細胞内へと受け渡す分子スイッチとして働いています。受容体の一種、G蛋白質共役型受容体(GPCR)の仲間はヒトがもっているタンパク質で最も多く普遍的に存在し、様々な生命活動を担っています。その重要性ゆえに、医薬品開発のターゲットとしてGPCRの構造機能研究が世界中で盛んに行われています。GPCRの3次元構造情報は医薬品を効率よく設計するために必要不可欠であり、詳細な構造を決定するためには目的の蛋白質の単結晶を用いたX線構造解析という手法が最も威力を発揮します。しかし、GPCRの良質な結晶を作成するのは非常に難しく、それは細胞膜の主成分としてGPCRが機能を発現するために必要な脂質が結晶化の妨げとなっているからです。
ロドプシンはGPCRの代表的な蛋白質として知られ、我々の眼の網膜にある視細胞で光センサーとして働いています。ロドプシンに含まれる赤い色素体レチナールが光を吸収すると、その光エネルギーを使ってロドプシンは細胞内の情報伝達分子であるGタンパク質に光情報を伝えます。
研究の内容
本研究では、新鮮なスルメイカを用い眼球の網膜組織からロドプシンのみを選択的に精製し3次元結晶化を行いました。様々な条件を試行した結果、赤橙色の六角形のイカロドプシン結晶を作成することに成功しました(図1)。この結晶を用いて大型放射光施設SPring-8の構造生物学III ビームラインBL38B1の放射光によるX線回折実験を行い、2.5Å分解能で立体構造を解明しました(図2)。この結晶は天然の脂質を十分に含んでおり、ロドプシンが結晶格子を形成するために脂質分子が重要な役割を果たしていました。
本研究から得られた結果を以下に示します。
1. GPCRの基本構造:膜領域の構造はGPCRに共通である(図3)。
2. 細胞質側G蛋白質共役部位:5番目と6番目のへリックス※5が細胞質に大きく突き出し、それに8番目、9番目のへリックスが結合した堅い構造(図2、3)。分子表面の電荷のプラス・マイナスがG蛋白質を引き寄せる(図4)。
3. 色素体11-cis型レチナールの構造:色の違いを感じるメカニズムを説明。
4. 入力部位から出力部位までへリックス間の空間に詰まった水分子:GPCRが細胞外側から細胞内側へと情報を伝える機構(図5)。
5. 膜中での二量体構造:GPCRが機能するために必要な構造(図6)
6. 積層した膜間での二量体構造:無脊椎動物が偏光を感じる構造的要因(図6)
研究の展開
無脊椎動物は、我々が感じることができない偏光を感知して羅針盤として活用したり、より明瞭な視界を獲得したりしています。スルメイカロドプシンの結晶構造から、偏光を検出するために必要な視細胞の形態がロドプシンどうしの結合によって維持されていることが分かりました。また、イカのロドプシンと同じGq型G蛋白質と共役するGPCRは、哺乳類の体内時計(メラノプシン)、アレルギー反応の受容体(ヒスタミン受容体)、記憶・学習を司る受容体(グルタミン酸受容体)、痛み受容体(ブラジキニン受容体)など多種多様です。イカロドプシンの構造によって、これらのGPCRがG蛋白質に情報を伝える領域の構造が初めて明らかになりました。スルメイカロドプシンの二量体構造は、多くのGPCRが生体内で機能する詳細なモデルを作るための鋳型を提供するものです。我々の体内ではGPCRの機能異常が直接疾病の原因となります。本研究の成果が、様々なGPCRをターゲットとした医薬品の開発に貢献することが期待されます。
<参考資料>
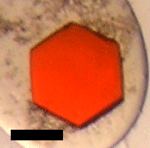 図1.イカロドプシンの3次元結晶写真
図1.イカロドプシンの3次元結晶写真ロドプシン溶液と沈殿剤溶液を混ぜて半年程度静置すると結晶が析出する。タンパク質自体は本来透明であるが、ロドプシンには色素体レチナールがタンパク質分子と結合しているため、色のついた結晶となる。スケールバーは100µm。
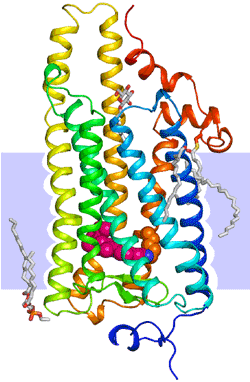 図2.イカロドプシンの結晶構造
図2.イカロドプシンの結晶構造ロドプシン1分子を青から赤への虹色のひもで示した。へリックス(らせん状のリボン)が膜領域(薄い水色の帯)を7回貫通する構造(= 7回膜貫通へリックス構造)はGPCRに共通の構造である。膜内部には色素体レチナール(濃いピンク色の球が連なったもの)がタンパク質部分と結合している。細胞内(上側)に大きくへリックスが突き出している。タンパク質の周りには天然の脂質分子(白色のギザギザした棒)が結合している。
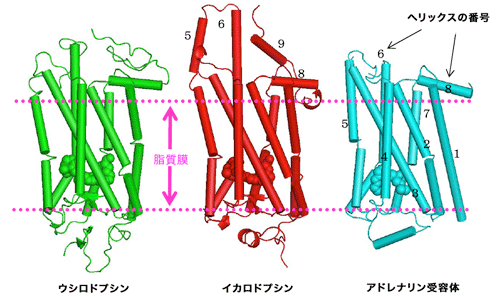 図3.これまでに構造解析された3種のGPCRの立体構造
図3.これまでに構造解析された3種のGPCRの立体構造タンパク質のへリックス構造を円柱で示した。膜領域(ピンク色の点線に挟まれた部分)の構造が良く似ているのは、GPCRが細胞外(下側)の情報を細胞内(上側)へと伝えるという共通の機能をもっているため。細胞質側領域(上側)も、Gタンパク質へと情報を伝える機能は同じであるために共通な構造をとると考えられるが、ウシロドプシン、アドレナリン受容体では揺らぎが大きく特定の構造が見られない。イカロドプシンは例外的にGタンパク質と結合し得る構造を保持している。細胞外領域(下側)は、受け取る情報が異なるために構造も異なる。
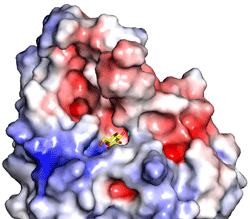 図4.細胞質側表面の電荷分布
図4.細胞質側表面の電荷分布ロドプシン分子の表面を滑らかな曲面で示した。様々な性質を持つアミノ酸のなかには電荷を帯びているものもあり、プラスとマイナスの電荷をもつアミノ酸はお互いに引力が働く。スルメイカロドプシンの細胞質側表面にはプラス(青色)とマイナス(赤色)の電荷をもつアミノ酸がそれぞれで集まって分布している。Gタンパク質の表面にも同様な電荷分布が見られ、GPCRとGタンパク質がお互いのプラスとマイナスに引かれ合って結合すると考えられる。
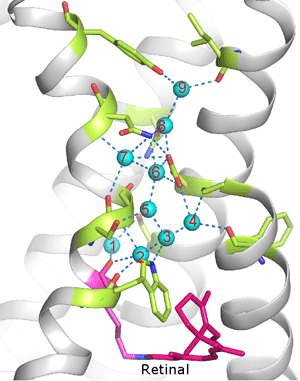 図5.へリックス間の空間に詰まった水分子
図5.へリックス間の空間に詰まった水分子9個の水分子(水色の球)はお互いに水素結合し(点線)、情報入力部位であるレチナール(ピンク色の棒)結合部位から出力部位である細胞質側表面(上側)までをつないでいる。イカロドプシンはこのネットワークを利用して光情報を伝えていると考えられる。
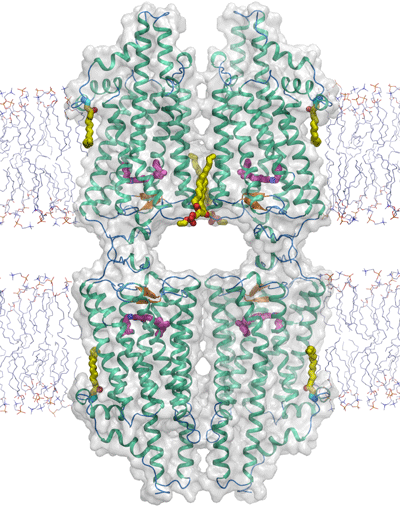 図6.結晶内でのロドプシンの会合状態
図6.結晶内でのロドプシンの会合状態結晶内で隣り合うロドプシン2分子は天然の脂質分子(黄色のギザギザ棒)をはさんで会合しており、この2分子構造(二量体構造)が生体内で細胞膜に埋め込まれた姿であると考えられる。GPCRは活性化すると二量体を形成すると報告されており、この二量体構造がGPCRが機能する構造であると示唆される。また、この二量体は膜を積層する方向にも強く結合し、4分子の構造体(四量体)を形成している。これらに含まれる色素体レチナールの方向が全て揃っていることから、この四量体構造がイカの視細胞の配向を決定すると考えられる。これは、無脊椎動物の眼が偏光を感知する構造学的要因である。
<用語解説>
※1 ロドプシン
動物の網膜の視細胞に存在する光センサー蛋白質。蛋白質部分であるオプシンとビタミンA誘導体であるレチナールが共有結合して複合体を形成している。ロドプシン内部でレチナールが光を吸収すると、11-シス型から全トランス型へと光異性化し、オプシンに構造変化を誘導する。さらに、結合したGタンパク質を活性化し細胞内情報伝達系を駆動し、視細胞を興奮へと導く。
※2 G蛋白質共役型受容体(GPCR)
7回膜貫通αへリックス構造をもつ膜受容体でヒトゲノム中最大のスーパーファミリーを形成している。細胞外の神経伝達物質やホルモンなど様々な刺激を受容し、Gタンパク質と呼ばれる情報伝達分子を介してその情報を細胞内情報伝達系に伝える。
※3 Gタンパク質
グアニンヌクレオチド結合タンパク質。ヘテロ三量体Gタンパク質はα,β,γサブユニットからなり、G蛋白質共役型受容体によって活性化される。
※4 偏光
光は進行方向に垂直な面で振動する電磁波であり、自然光は電磁波の振動方向が一定でなく、すべての方向の振動を含んでいる。特定の方向にしか振動していない光を偏光という。
※5 へリックス
タンパク質はDNAから翻訳されたアミノ酸が連結し、一本鎖となって折りたたまれて固有の立体構造を形成する。このとき、部分的に安定ならせん状の構造がよく見られる。このらせん構造をへリックスという。
|
<問い合わせ先> (SPring-8に関すること) |
- 現在の記事
- スルメイカの光センサー蛋白質の立体構造を解明-細胞外の情報を細胞内へと伝える分子スイッチの構造が明らかに-(プレスリリース)