アルツハイマー病の原因となる酵素の活性調節機構を解明 - アミロイド前駆体を捕まえるポケットの大きさと水分子の存在が決め手 -(プレスリリース)
- 公開日
- 2008年05月22日
- BL26B1(理研 構造ゲノムI)
- BL26B2(理研 構造ゲノムII)
- BL44B2(理研 物質科学)
平成20年5月22日
独立行政法人 理化学研究所
本研究のポイント
○ 原因酵素BACE1の活性は大きく開いたポケット構造でアミロイド前駆体をキャッチ
○ BACE1の非活性型は、ポケットの内部での切断に重要な水分子を減少させる
○ 新しいアルツハイマー病薬創製へ向けた応用研究に期待
|
独立行政法人理化学研究所(野依良治理事長)は、アルツハイマー病発症の原因となる酵素「ベータ(β)セクレターゼ(BACE1)※1」の活性型立体構造を決定し、活性調節のメカニズムを解明しました。理研脳科学総合研究センター(田中啓治センター長代行)構造神経病理研究チームの貫名信行チームリーダー、清水英明研究員(現:理研生命分子システム基盤研究領域システム研究チーム研究員)による研究成果です。 (論文) |
1.背景
高齢化社会を迎えた現在、認知症性疾患への対策は社会的に重要な課題です。現在、国内に約100万人以上もの認知症の高齢者がいると考えられ、その約半分がアルツハイマー病患者であるとされています。今後、その数は増加すると予測されるため、早期の治療薬の開発が求められています。アルツハイマー病は、ベータ(β)セクレターゼ(BACE1)とガンマ(γ)セクレターゼと呼ばれる2つの酵素によって、アミロイド前駆体タンパク質(APP)を切断して、老人斑を構成するアミロイドベーターペプチド(Aβ)を作ることが原因と考えられています(図1)。これら2つの酵素の阻害剤は、アルツハイマー病の治療薬として最も期待されており、世界中でその研究開発が精力的に行われています。現在、さまざまな種類のBACE1阻害剤が開発中ですが、注射薬や内服薬として使用するためには、分子の小型化など多数の改良が必要です。
タンパク質と薬剤との関係は鍵と鍵穴に例えられるように、それぞれの形に大きく依存します。薬剤が作用する部分のタンパク質の形がわかると、その形状を反映した化合物をデザインすることが可能になります。また、タンパク質は、周辺の環境によって形や性質が変化し、それに伴ってタンパク質の活性状態や薬剤との結合力も変化します。高活性状態のタンパク構造、もしくは薬剤が結合しやすい状態のタンパク構造などを明らかにできると、より効果的な薬剤を効率的にデザインすることが可能となります。
2.研究手法と成果
BACE1の活性は、周辺の環境、特にpHによって大きく変化します(図2)。実際、生体内でも酸性的な細胞内小器官※2などで活性化していると考えられます。しかし、活性状態のBACE1がどのような形をしているのか、また、周辺環境に応じてどのように活性をコントロールしているのかは、これまでわかっていませんでした。
研究チームは、大型放射光施設SPring-8の理研構造ゲノムビームラインBL26B1、BL26B2、理研構造生物学ビームラインBL44B2を利用して、BACE1のX線結晶構造解析を行いました。X線結晶構造解析は、結晶化したタンパク質を測定に使用しますが、今回の研究では、BACE1の活性状態に応じた結晶調整方法を確立しました。そのため、活性状態を厳密に反映したBACE1の微妙に変化した立体構造を解析することが可能になり、今まで不明だった活性型BACE1の立体構造を決定することができました。これらの解析結果を用いて、BACE1の立体構造と活性の関係について詳細な解析を行いました。
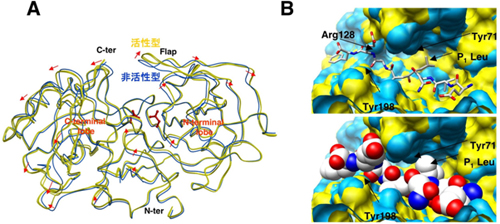
その結果、BACE1が活性状態になるとAPPを取り込むためのポケットが大きく開くとともに、ポケット内部の形状もAPPを選択的に取り込めるように変化していることがわかりました(図3A、B)。一方、非活性型のpH7以上ではポケットは閉じているため、APPが活性部位に入り込むことができませんでした。また、非活性状態のpH4以下では、ポケットは十分な大きさであるものの、APPの切断反応に必要とされる水分子が著しく減少しているため、切断反応が起こらないことも明らかにしました(図4)。
これらの複合的な構造変化によって、BACE1はAPPの取り込みや切断反応を厳密にコントロールしていると考えられます(図5)。
3. 今後の期待
従来のBACE1阻害剤の設計には、非活性型の立体構造がモデルとして広く使われてきました。この非活性型BACE1は、薬物結合を邪魔するような形状をしているため、薬剤に対する結合力は低く、薬剤設計のひな型としては適していませんでした。一方、活性状態のBACE1は、低濃度の薬剤でも十分に結合することから、薬剤を取り込みやすい形状をしていることになります。今後、活性型BACE1の構造情報を用いた新たな薬剤の設計や既存の阻害剤の改良など、治療薬実用化へ向けた研究が促進することが期待できます。また、活性調節機構に関する知見をもとに、生体内でBACE1の働きをうまく制御するような薬剤の開発への糸口ともなります。
<参考資料>
 |
|
| 図3 活性型(黄)、非活性型BACE1(青)の構造比較 | |
| A: | BACE1の全体構造の比較。中央上部のくぼみにAPPが結合する。活性に応じてくぼみが開閉する。矢印は非活性型から活性型への変化を表している。 |
| B: | くぼみ内部のAPP結合部位表面の形状比較。APPのモデルとしてOM99-2(白)を合成(上:スティックモデル、下:空間充填モデルで表示)。結合部位周辺の形状も変化している。 |
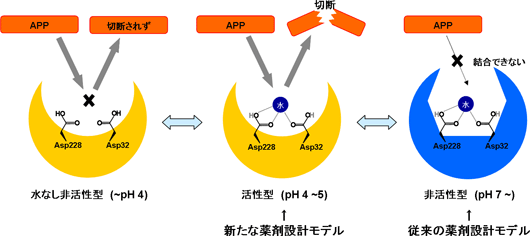 図5 BACE1における活性調節機構
図5 BACE1における活性調節機構pH 7.0付近では、BACE1はAPPと結合ができない非活性型構造(青)をしている。pH 5.0 以下になると、BACE1はAPPと結合可能な活性型構造(黄)へシフトし、APPの切断が可能になる。またpH 4.0以下では、ハサミの役割をする水分子が減少するため、APPが結合しても切断することができない。
<用語解説>
※1 ベータ(β)セクレターゼ(BACE1)
501個のアミノ酸で構成される膜貫通型のアスパラギン酸プロテアーゼ。活性中心に2つのアスパラギン酸があり、酸性環境下で活性を持つ。BACE1欠損マウスが明らかな異常を示さなかったことから、BACE1阻害剤は重篤な副作用がないことが期待され、アルツハイマー病の治療標的として有力視されている。
※2 細胞内小器官
核、小胞体、ゴルジ体、エンドソーム、リソソームなど細胞の内部で特に分化した形態や機能を持つ構造の総称。BACE1は主に後期ゴルジ体、エンドソームなど酸性化した細胞内小器官に局在し、細胞膜との間を循環していると考えられている。
|
<問い合わせ先> (研究に関すること) 脳科学研究推進部 企画課 (報道担当) (SPring-8に関すること) |
- 現在の記事
- アルツハイマー病の原因となる酵素の活性調節機構を解明 - アミロイド前駆体を捕まえるポケットの大きさと水分子の存在が決め手 -(プレスリリース)
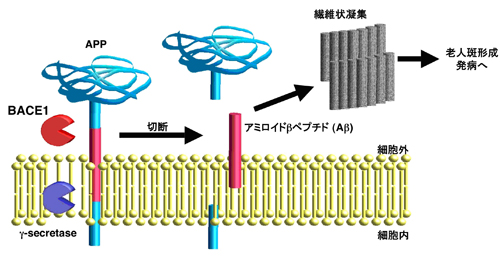 図1 BACE1とγ-secretase によるAβ産出機構
図1 BACE1とγ-secretase によるAβ産出機構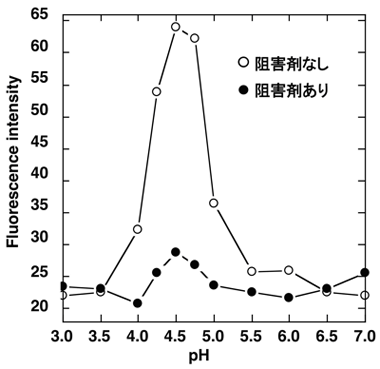 図2 BACE1活性とpHの関係
図2 BACE1活性とpHの関係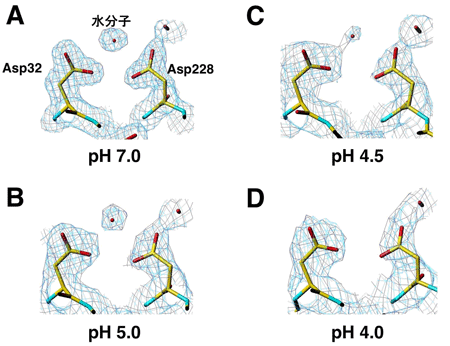 図4 活性中心の水分子の電子密度の変化
図4 活性中心の水分子の電子密度の変化