21番目のアミノ酸「セレノシステイン(Sec)」の合成メカニズムを解明 -星形の超巨大複合体がSec合成を一度に成し遂げる-(プレスリリース)
- 公開日
- 2013年04月05日
- BL41XU(構造生物学I)
2013年4月5日
独立行政法人 理化学研究所
国立大学法人 東京大学
本研究成果のポイント
• Secの合成に必要な酵素「SelA」の立体構造を決定
• 星形の巨大タンパク質「SelA」の4つのサブユニットが異なる作業を担いSecを合成
• セレン(Se)の自在な導入によるスーパー酵素の創生などへ期待
|
理化学研究所(野依良治理事長)と東京大学(濱田純一総長)は、バクテリアにおける「21番目のアミノ酸※1」と呼ばれるセレノシステイン(Sec)の合成メカニズムを解明しました。これは、理研生命分子システム基盤研究領域の横山茂之領域長(横山茂之領域長、現:横山構造生物学研究室 上席研究員)、東京大学分子細胞生物学研究所の伊藤弓弦助教らと米国イェール大学による共同研究成果です。 (論文) |
背 景
セレン(Se)は、周期表の酸素と硫黄の下に位置し、硫黄と似た性質を持ちますが、より反応性に富んでいます。そのため、ヒトからバクテリアに至る幅広い生物にとって微量成分として不可欠で、Seの欠乏は、がんや高血圧症を引き起こします。生体内では主にセレノシステイン(Sec)とよばれるアミノ酸に存在し、一部のタンパク質(Se含有タンパク質)に取り込まれます。Se含有タンパク質はSeの高い反応性を利用して、抗酸化作用など重要な機能を発揮します。
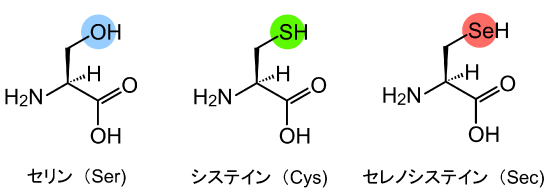
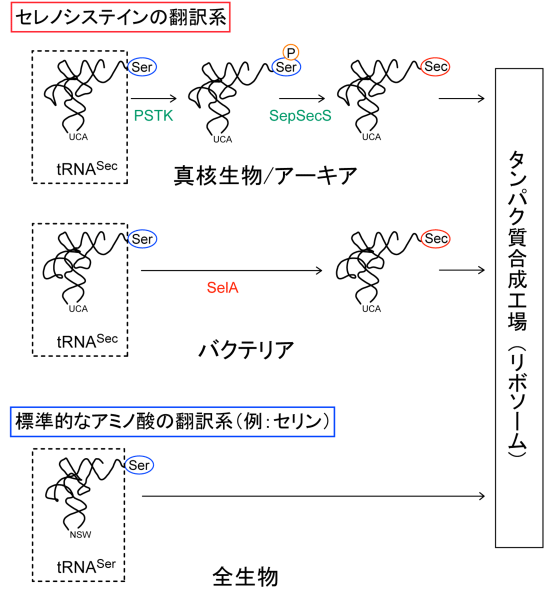
Secは、タンパク質を構成する標準的な20種のアミノ酸に加えて、新たに発見された「21番目のアミノ酸」として知られています(図1)。標準的なアミノ酸と同様に、遺伝暗号に従ってタンパク質に取り込まれます。その際、アミノ酸をタンパク質合成の場であるリボソーム※7に運搬するには、それぞれ専用のtRNAが必要で、Secには専用のtRNASecが存在します。通常のtRNAは、それぞれに対応するアミノ酸が結合しますが、tRNASecは、まず一度、別のアミノ酸である「セリン(Ser)」(図1)が結合します(Ser-tRNASec)。その後、SerがSecへ変換され、Sec-tRNASecが合成されて、リボソームに運搬されることでタンパク質に取り込まれます(図2)。
この変換メカニズムは、ヒトを含めた真核生物とアーキアのグループ(ヒト型)とバクテリアのグループ(バクテリア型)では全く異なります。ヒト型では、2つの酵素「PSTK」と「SepSecS」によって、2段階でSerからSecへと変換されます。一方、バクテリアでは1つの酵素「SelA」によって、1段階でSerをSecに変換します(図2)。2010年の本研究グループの成果などにより、ヒト型のメカニズムの全容が明らかになりました注)が、バクテリア型のメカニズムの研究は巨大タンパク質であるSelAの結晶構造解析が技術的に困難であったため大きく遅れており、その解明が求められていました。
注)2010年8月13日プレスリリース:
http://www.riken.jp/pr/press/2010/20100813/digest/
研究手法と成果
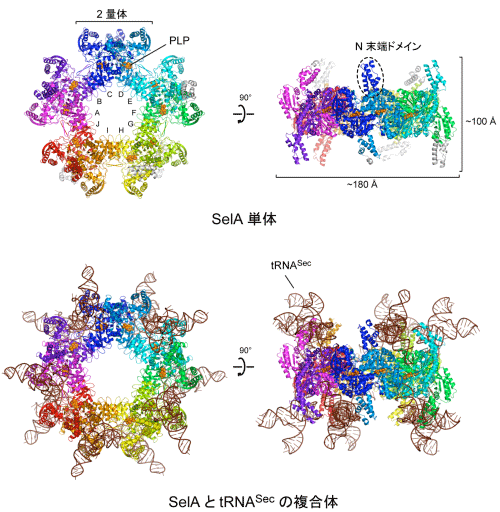
共同研究グループは、バクテリアの一種A. aeolicus(A.アエオリカス)由来のSelA単体、およびSelAとtRNASecの複合体の結晶を作製し、理研の大型放射光施設SPring-8※8のビームラインBL41XUと、高エネルギー加速器研究機構の放射光科学研究施設フォトンファクトリー※9のビームラインBL5A、BL17A、NW12Aを用いて結晶構造を解析しました。その結果、SelAは、2個のサブユニットからなる2量体が5個、星形に配列した10量体であることが分かりました(図3上)。全てのサブユニットは互いに同じ構造であるため正5角形型の対称性を持ちます。その分子量は通常のタンパク質が数万であるのに対し、SelAの総分子量は50万を超えます。そして、SelAとtRNASecの複合体では、合計10個のtRNASecがSelAに結合しており、総分子量81万の超巨大タンパク質-RNA複合体を形成していました(図3下、動画:http://youtu.be/v4a55kmbXL8)。この大きさは、全ての細胞に存在するタンパク質合成の場であるリボソームの30S粒子にも匹敵します。
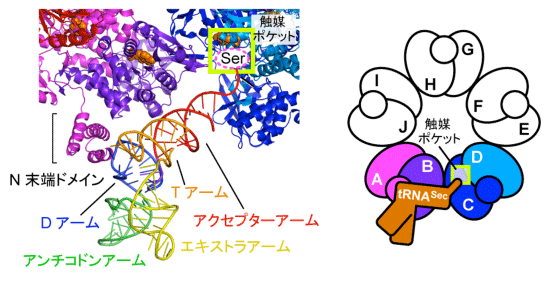
SelAと共通の先祖を持つ他の酵素は、2量体か4量体で機能します。一方、SelAは10量体で、このような巨大な構造は他に例がなく、なぜ超巨大な複合体が必要なのか、その詳細な機能について調べました。その結果、SelAの中で、隣り合う2個の2量体に含まれる4個のサブユニット(図4右A~D)は、1つのSer-tRNASecに対し、協力して4つの異なる作業を担うことが分かりました。具体的には、サブユニットAが(1)「Ser-tRNASecを識別し」、サブユニットAとBが(2)「Ser-tRNASecを固定し」、サブユニットCが(3)「Ser-tRNASecの先端を捕まえ」、サブユニットCとDが(4)「その先端にあるSerをSecへと変換する」、という連続した作業により、1段階でSerをSecに変換すると分かりました(図4)。また、サブユニットは全て同じ構造であるため、隣のSer-tRNASecに対しては、C~Fの4個のサブユニットが4つの作業を担い、サブユニットCに着目すれば、このときには(1)と(2)を担当しています。このように各サブユニットは4つの作業を全て担うことが出来ます。これらのサブユニットをそれぞれのtRNASecに対して機能させるためには、2量体の配置が重要であり、これを実現するためにバクテリアでは、超巨大な正5角形型の星形構造を産み出したことが分かりました。さらに、環状に5つの2量体を配置することで、全体では、(1)~(4)の作業が10カ所で可能です。もし、直線状に配置した場合は、両端に無駄ができるため、全体で8カ所だけとなり非効率的です。このように環状であることの重要性も判明しました(図4)。
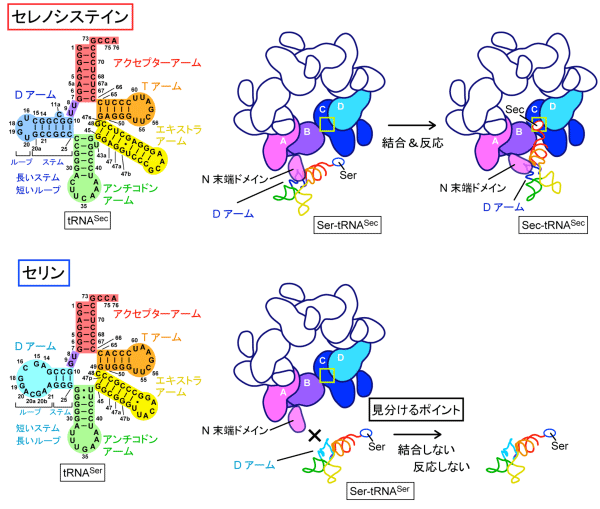
また、SerからSecへの変換は、反応性に富むSeを組み込む困難な反応であるとともに、tRNASerなど他のtRNAにSeを導入しないよう、正確に識別する必要があります。そのメカニズムを詳細に調べたところ、SelAは、星型の構造から突出した領域(N末端ドメイン:図3上右、図4左)が、tRNASecが持つ固有のDアームと結合することで、tRNASecを正確に識別していると分かりました(図5)。
さらに、ヒト型で働くSepSecSとバクテリア型で働くSelAでは、SerからSecへの変換を触媒する部位の構造が全く異なることも判明しました。Secを合成するこれらの酵素は、互いの構造も反応メカニズムも異なります。つまり、ヒト型とバクテリア型の酵素は、別々の先祖から、それぞれ独立にSecを合成できるように進化(収れん進化)したという非常に興味深いことも分かりました。
今後の期待
Se含有タンパク質は、ヒトの生存や健康の維持に必須で、その研究は大変重要です。しかし現状では、Secを自在にタンパク質へ取り込むことができないため、人工的な合成は困難です。今回、ヒト型に続きバクテリア型の生体内のSec合成メカニズムも解明できました。今後、人工的なSe含有タンパク質合成方法の開発に大きく貢献し、Seの自在な導入によって今まで出来なかった天然の酵素の機能を上回る能力を持つスーパー酵素の創生や、Se欠乏を原因とする疾患の研究などに役立つことが期待できます。
アーキアとバクテリアの多くは、基本的な20種類のアミノ酸のうちの幾つかについても、Sec合成のようにtRNA上で他のアミノ酸を経由して合成しています。これは原始生物の名残とされ、初期の生物は少ない種類のアミノ酸からタンパク質を合成し、進化の過程で新しいアミノ酸を獲得していったと考えられています。タンパク質を構成するアミノ酸の並びはDNA上の遺伝子に規定されているため、新規のアミノ酸の獲得には遺伝暗号とその翻訳系の進化が必要です。Secの翻訳系は最も歴史の浅い未熟なものであるため、Secの合成から組み込みまでのメカニズムを詳細に調べ、完成されたアミノ酸の翻訳系と比較することは、原始の生物が遺伝暗号を進化させながら現在の姿に至った経緯をひも解く手がかりになると期待できます。
《参考図》
Secは、Serの酸素(O)またはCysの硫黄(S)がセレン(Se)に置き換わったアミノ酸である。
上:真核生物/アーキアのSecの翻訳系
2つの酵素「PSTK」と「SepSecS」によって、2段階でSerからSecへと変換される。まず、PSTKがSer-tRNASecを識別し、Serにリン酸基(P)を転移して目印とする。次に、SepSecSが目印のあるSerだけをSecに変換する。
中:バクテリアのSecの翻訳系
1つの酵素「SelA」によって、1段階でSerをSecに変換する。
下:標準的なアミノ酸の翻訳系
上:SelA単体
星型の正面(左)と側面(右)から見た図で、N末端ドメインが星型の板状構造から突き出している。10個のサブユニットが環状に配置した星型の構造で、10個ある触媒ポケットには、酵素の働きを助ける補酵素の1種「ピリドキサールリン酸(PLP)」が結合している。PLPはビタミンB6が体内で形を変えたもので、SelAの他、様々な酵素の活性を担う。
下:SelAとtRNASecの複合体
星型の正面(左)と側面(右)から見た図。
合計10個のtRNASecがSelAに結合している。
(YouTube:SelAとtRNASecの複合体の全体構造動画)
SelAのサブユニットAとBに結合したtRNASecを拡大した図。サブユニットAのN末端ドメインがtRNASecの特徴的なDアームと結合してtRNASecを識別している。4つのサブユニット(A~D)は、1つのSer-tRNASecに対し、協力して4つの異なる作業を担う。サブユニットAが(1)「Ser-tRNASecを識別し」、サブユニットAとBが(2)「Ser-tRNASecを固定し」、サブユニットCが(3)「Ser-tRNASecの先端を捕まえ」、サブユニットCとDが(4)「その先端にあるSerをSecへと変換し」、1段階でSerをSecに変換する。
なお、サブユニットは全て同じ構造であるため、隣のSer-tRNASecに対しては、サブユニットCが(1)を、サブユニットCとDが(2)を、サブユニットEが(3)を、サブユニットEとFが(4)を担う。また、向かい合うSer-tRNASecに対しては、サブユニットDが(1)を、サブユニットDとCが(2)を、サブユニットBが(3)を、サブユニットBとAが(4)を担う、というように、各サブユニットは4つの作業を全て担うことができる。
上: セレノシステインのtRNASecの識別メカニズム
SelAのN末端ドメインは、tRNASecが固有に持つDアームの構造と結合し、tRNASec上のSerをSecに変換する。Dアームはステムとループから成っており、tRNASecのDアームはステムが長く、ループが短い特徴を持つ。
下:セリンのtRNASerの識別メカニズム
tRNASerを含む標準的なアミノ酸に対応するtRNAのDアームはステムが短く、ループが長い。このためtRNASerのDアームはSelAと結合できず、tRNASerに付いたSerがSecに変換されることはない。
《用語解説》
※1 21番目のアミノ酸
一般に、タンパク質は20種類のアミノ酸を鎖状に連結させたもの。アミノ酸配列は遺伝暗号としてDNAの塩基配列により規定され、塩基配列→アミノ酸配列への変換を「翻訳」と呼ぶ。アミノ酸の連結は、DNAの転写物である伝令RNA(mRNA)によりリボソームで行われる。mRNAの塩基は、A、U、G、Cの4種類で、その連続する3つの塩基をコドンと呼ぶ。コドンは4×4×4の計64種類で、その内61種が20種類のアミノ酸のいずれかに対応し(例:UCAコドンとAGUコドンはセリンに対応)、残りの3種類はアミノ酸の連結を終結させる(終止コドン)。ヒトを含む多細胞動物や、植物、原生動物、アーキア、バクテリアの一部には、セレノシステイン(Sec)というアミノ酸があり、標準的な20種類に加えて新たに発見されたことから「21番目のアミノ酸」と呼ばれる。Secのコドン(UGAコドン)は終止コドンで、mRNA上に特別な配列がある時だけSecのコドンとして働く。
※2 転移RNA(tRNA)
転移リボ核酸(transfer RNA)の略号。RNAの一種で、A、U、G、Cが70~100個鎖状に連結したものである。アミノ酸ごとに1~数種類のtRNAが存在する。tRNAはそれぞれ対応するアミノ酸を末端に結合し、リボソームまで運搬する。リボソームにアミノ酸を受け渡すと、再びアミノ酸を結合して、リボソームまで運搬する働きを繰り返す。tRNAはアクセプターアーム、Dアーム、アンチコドンアーム、エキストラアーム、Tアームの5つ領域から構成されている。それぞれのアームは、向かい合う塩基同士が対合した二重ら旋構造の領域(ステム)と、先端の二重ら旋を取らない領域(ループ)を持つ。アクセプターアームの先端にはアミノ酸が結合し、アンチコドンアームの先端の3塩基はアンチコドンと呼ばれ、リボソーム内でmRNAのコドンと対合する。DアームとTアームが3次元的に相互作用してL字型の立体構造を取り、L字からエキストラアームが突き出す。
※3 真核生物
細胞内にDNAを収納した核という小器官を持つ生物の一群。ヒトを含む多細胞動物、真菌類(カビやキノコ)、植物、原生動物などが属する。
※4 アーキア
古細菌とも呼ばれる微生物の一群。真核生物、バクテリアと共に生物を分類する3つの大分類群の一員である。核を持たない点で真核生物と異なるが、アミノ酸やタンパク質の合成など基本的なシステムは真核生物と酷似しており、バクテリアよりも真核生物に近縁である。メタン菌、好塩菌、超好熱菌など極限環境に生息するものが多い。
※5 バクテリア
細菌または真正細菌とも呼ばれる核を持たない微生物の一群。大腸菌、枯草菌(納豆菌)、乳酸菌、サルモネラ菌などが属する。
※6 サブユニット
タンパク質は1本のアミノ酸重合鎖(ポリペプチド鎖)から成るもの(単量体タンパク質)と、複数本の鎖から成るもの(多量体タンパク質)がある。多量体タンパク質を構成する各々のポリペプチド鎖をサブユニットと呼ぶ。
※7 リボソーム
タンパク質を合成する細胞小器官。自身も巨大なRNA-タンパク質複合体である。リボソームはmRNAを取り込み、mRNAのコドンとtRNAのアンチコドンを対合させることで、アミノ酸を結合したtRNAを呼び込み、コドンの順番通りにアミノ酸を連結する。リボソームは大小2つの粒子がダルマ状に重なった構造で、バクテリアの場合、大小の粒子はそれぞれ50S粒子と30S粒子と呼ばれ、真核生物の場合は60Sと40Sと呼ばれる。
※8 大型放射光施設SPring-8
理研が所有する兵庫県の播磨科学公園都市にある世界最高級の放射光を生み出す施設。その運転管理と利用者支援は高輝度光科学研究センター(JASRI)が行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する強力な電磁波のこと。SPring-8では、この放射光を用いて基礎科学から産業利用までの幅広い研究が行われている。
※9 放射光科学研究施設フォトンファクトリー
茨城県つくば市にある放射光科学研究施設。日本初のX線を利用できる放射光専用光源として1982年に完成した。大学や研究機関が共同で利用実験するための施設(大学共同利用機関)として高エネルギー加速器研究機構(KEK)によって運用されている。
|
《問い合わせ先》
(報道担当)
公益財団法人高輝度光科学研究センター 広報室 |
- 現在の記事
- 21番目のアミノ酸「セレノシステイン(Sec)」の合成メカニズムを解明 -星形の超巨大複合体がSec合成を一度に成し遂げる-(プレスリリース)