「自己免疫疾患の新しい発現機構を発見!」-X線を用いて抗原複合体1分子動態連続計測に成功- (プレスリリース)
- 公開日
- 2015年01月21日
- BL40XU(高フラックス)
2015年1月21日
国立大学法人東京大学
東京理科大学
公益財団法人 高輝度光科学研究センター
研究成果のポイント
•主要組織適合性抗原(MHC)上に提示される病原体由来のタンパク質断片(抗原ペプチド)の1分子内部動態を高速X線回折像からリアルタイム動画撮影に成功。
•抗原ペプチド1分子内部動態はMHC本体の分子動態と独立であることを実証。
•自己免疫疾患を起こす抗原ペプチドは分子内部動態が激しく、新たな認識構造を生み出す可能性があるため、この動きを制御できれば、新しい免疫病予防法が実現可能。
|
東京大学大学院新領域創成科学研究科の佐々木裕次教授と東京理科大学生命医科学研究所の小園晴生准教授を中心とする研究グループは、体内に侵入した病原体を免疫細胞に提示する分子である主要組織適合性抗原(MHC)(注1)分子が、病原体由来のタンパク質断片(抗原ペプチド)とどのように結合し、免疫応答を活性化しているかを、SPring-8(注2)BL40XUビームラインで1分子内部動態測定をすることにより、世界で初めて実験的に明らかにした。 自己免疫を起こしやすい抗原ペプチド(注3)は、ゆるくMHC分子と結合することが以前より知られていた。しかし、このゆるい結合が免疫応答の分子認識機構にどう関わっているか実験的にはわからなかった。本研究成果により、抗原ペプチドの分子軸に対して回転方向の動きが特に活発化し、抗原ペプチドとMHCの複合体が新たな構造をとり、潜在的自己反応性のT細胞(注4)と反応することが分かった。 研究グループは、マウスのMHC分子に14個のアミノ酸からなる「長い抗原ペプチド」と10個のアミノ酸からなる「短い抗原ペプチド」が結合している場合のそれぞれの分子内部動態を、高精度と高速性を持ち合わせる唯一の1分子計測法であるX線1分子追跡法(DXT)(注5)、抗原ペプチド1分子動態の計算、多分子からの蛍光偏光解消法(注6)を用いて調べた。その結果、MHC分子とゆるく結合する「短い抗原ペプチド」は「長い抗原ペプチド」よりMHC分子内でよく動き、新たな構造をとっていることが明らかになった。 本成果は、佐々木らが考案実証した量子ビームを用いた1分子計測手法と計算科学の手法を融合することによって得られたものであり、このような手法は免疫学の分野において有効であり、非常に重要な結果を導けることを示した。 (論文) |
発表内容
MHC分子は細胞内にある抗原ペプチドと結合してそれを細胞表面まで運び、免疫細胞の一種であるT細胞に提示するタンパク質分子である。抗原ペプチドと結合したMHC分子(抗原ペプチド/MHC複合体)をT細胞上のT細胞受容体が認識すると体内の免疫応答が始まる。最近、たった一つの抗原ペプチドと結合したMHC分子が抗原性(複数のT細胞と特異的に認識して結合する性質)を示すことが明らかになり、それぞれを認識するT細胞の存在が明らかになった。研究グループは、MHCと結合する部分のアミノ酸配列は同じだが、MHC分子のペプチド収容溝(注7)と同じ長さの「短い抗原ペプチド」と、それよりも4残基長い「長い抗原ペプチド」を準備した。この2つのペプチドの分子内部動態(注8)を、DXTと蛍光偏光解消法、そして分子動力学計算(注9)を用いて比較することでT細胞の認識の違いを明らかにできると予測した。
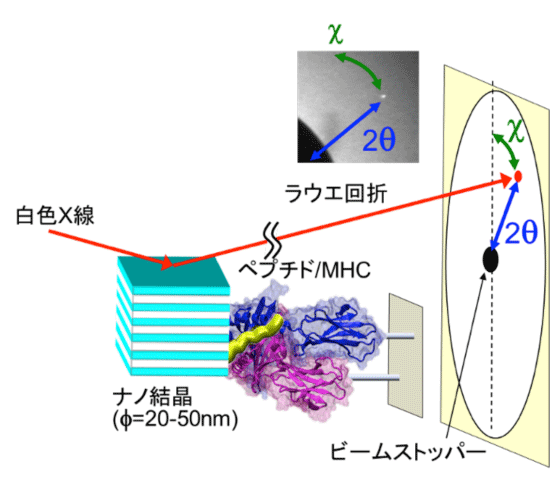
DXTは、数十nm(ナノメートル)の超微小金ナノ結晶を観察タンパク質分子に化学的に標識し、分子内部運動に連動した標識(ナノ結晶)の動きをX線回折斑点の動きとして高速時分割追跡する1分子動画計測手法である。この1分子計測手法は、現在、世界最高精度で最高速度を誇る1分子動画計測手法である。
今回、マウスのMHC分子MHC I-Akにニワトリ卵白リゾチームタンパク質由来の長さの異なる2つの抗原ペプチドを結合させ、MHC分子自体の動きを観察し、またそのペプチド上のT細胞受容体の認識部位に変異(システイン残基)を入れ、そこにナノ結晶を結合させ抗原ペプチドの分子内部動態を観察した。その結果、抗原ペプチドとMHC分子は非常に似通った動きをするが、抗原ペプチドの動きの方がMHC分子より大きく、独立した動態をしていた。また複数のT細胞を活性化する短い抗原ペプチドはMHC分子内で回転方向の動きがより大きいことが判明した。その動態は、抗原ペプチド/MHC複合体に新たな構造、つまり潜在的自己反応性のT細胞の認識できる構造を一時的に形成することを示している。
この事実を確認するために、多分子の平均的動態情報が得られる蛍光偏光解消法で2つの抗原ペプチドの運動に差が検出されるか調べ、同様に短い抗原ペプチドが速く動いていることがわかった。また、分子動力学計算の結果から、長い抗原ペプチドのうちMHC分子のペプチド収容溝に入りきらない部分はMHC分子に結合しているのではなく大きく溶媒中でゆらいでいることがわかった。その分、ペプチド収容溝の中の残基は動かなくてもエントロピーの減少を防げることもわかった。
このようにDXTはミリ秒の動きを計測し、蛍光偏光解消法と分子動力学計算ではナノ秒の動きを観察し、1分子の計算をしたが、すべての方法で短い抗原ペプチドがよく動くということが明らかになった。安定性の低いMHC複合体は、それと反応するT細胞が胸腺で除去される(負の選択)のを免れる。しかしながら、炎症が起こるとT細胞活性化の補助分子がたくさん発現することでそれらの自己反応性のT細胞も活性化される。ペプチド非結合的領域を持つために強く結合するペプチドは胸腺で負の選択を起こし、それらに反応するT細胞は末梢にはほとんど存在しない。今回は、MHC分子と強く結合する長い抗原ペプチドと弱く結合する短い抗原ペプチドの違いは、後者がMHC分子の中でよく動き新たな構造を生み出すことにあるという発見ができた。研究グループは現在、自己反応性のT細胞との反応性を変えずによく動きながら強く結合する変異ペプチドを分子動力学計算で検索し、自己免疫疾患、あるいはそれを逆に癌などの曖昧な自己を標的とした免疫療法として利用することを計画している。
《用語解説》
(注1)主要組織適合性抗原(The Major Histocompatibility Complex, MHC)
T細胞受容体と結合するタンパク質で、細胞内に存在する抗原タンパク質の断片(抗原ペプチド)と結合し、細胞表面に提示される。T細胞はペプチドとMHC分子の複合体の微妙な構造の差を検知し活性化する。MHC分子にはクラス IとクラスIIの二種類があり、それぞれCD8 T細胞とCD4 T細胞の活性化に関与する。この研究で用いたのはMHC クラス IIである。
(注2)大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設で、その運転管理と利用者支援等は高輝度光科学研究センター(JASRI)が行っている。SPring-8の名前はSuper Photon ring-8(ギガ電子ボルト)に由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する、細く強力な電磁波のこと。SPring-8では、この放射光を用いて、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究が行われている。
(注3)抗原ペプチド
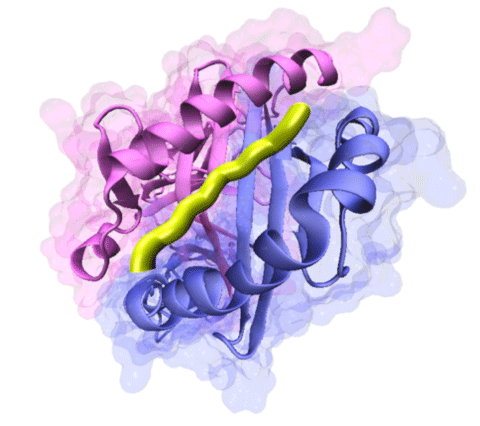
ウィルスや細菌などの病原体由来のタンパク質断片を指す。MHC分子に結合する抗原ペプチドは、そのほとんどがタンパク質を分解したペプチドである。細胞外から侵入したウィルスやバクテリアはそれ固有のタンパク質を有しているため、感染が起こっている時といないときでペプチドのレパートリーが変わってくる。細胞はMHC分子にペプチドを乗せるため効率のよい抗原提示経路を持っている。下図は、黄色い部分が抗原ペプチドで、その周りがMHC分子の構造モデル。
(注4)潜在的自己反応性のT細胞
体内に存在するT細胞は胸腺で自己に反応するもの(自己反応性)は負の選択を受け除去される。自己反応性のT細胞が自己のペプチドと自己のMHC複合体を強く認識すると、死んでしまうという機構である。ところが、末梢中にも自己反応性のT細胞が多々あることが近年わかってきた。負の選択を免れるもの理由の一つが抗原ペプチド/MHC複合体の安定性の低さである。
(注5)X線1分子追跡法 (Diffracted X-ray Tracking; DXT)
数十ナノメートル程度のナノ結晶をタンパク質に標識し、タンパク質の内部動態に連動したナノ結晶の動きを、ナノ結晶からのX線回折斑点の動きとして高速時分割追跡する手法。佐々木裕次教授が1997年に考案し、2000年に発表し、今までに多くのタンパク質の内部運動を計測し論文を発表してきた(Physical Review Letters, Physical Review E, BBRC, Cell, PLoS ONE, Scientific Report, RSI等)。2014年ノーベル化学賞は「超解像顕微法の考案」に貢献した三氏が受賞したが、その基本原理には1分子計測研究の進展が大きく貢献しており、このDXTも「超解像」的な発想を用いた手法で、かつ世界で初めてÅ(オングストローム、1Åは10ナノメートル)レベルの波長を持つ量子ビームでの「超解像法」の実現と定義できる。下図は、本研究で用いたペプチド/MHC分子の構造変化モデルにDXT法を適応した図。本受容体の運動を示すために動画も添付した。
(注6)蛍光偏光解消法
偏光励起光を蛍光物質に照射することにより、蛍光物質から発せられる蛍光が分子の回転する速度に応じて異なった偏光度を示すという測定方法。蛍光分子により標識された分子の回転速度が速いと偏光が解消され、偏光度は小さい値を示す。反対に分子の回転速度が遅いと蛍光の偏光は解消せず偏光度は大きな値を示す。
(注7)ペプチド収容溝
MHC分子は抗原ペプチドと結合するが、MHC分子の表面で結合するわけではない。ペプチド収容溝というアミノ酸7~9残基分ほどの溝があり、抗原ペプチドはそこに嵌まり込みMHC分子の折り畳みの一部となる。ペプチド表面で溶媒中に露出される部分はごく一部に過ぎない。
(注8)分子内部動態
一般に分子内部動態とは、タンパク質分子において機能発現時に起こる分子運動の総称である。現在、分子内部動態を高精度に計測できる1分子計測法は、本DXTのみ。可視光を用いた1分子計測は、その波長限界から分子の並進的な運動は計測できるが、内部の回転運動を計測できる精度に達していない。ノーベル賞を受賞した「超解像顕微鏡」も分子内部動態は計測不可能。
(注9)分子動力学計算
タンパク質や生体分子の振る舞いをコンピュータで計算しシミュレーションする方法。まず結晶解析で得られた原子配置を基に、古典力学におけるニュートン方程式を解いて、原子がどう運動するか計算する。これにより一定時間後に原子の配置が元の位置からどう変わったがわかる。計算を重ねることにより、原子が徐々に動いていく様子を再現できる。2013年のノーベル化学賞はこの方法の発展に大きく寄与した3名が受賞した。
|
《問い合わせ先》 東京理科大学 生命医科学研究所 小園 晴生 准教授 (SPring-8に関すること) |
- 現在の記事
- 「自己免疫疾患の新しい発現機構を発見!」-X線を用いて抗原複合体1分子動態連続計測に成功- (プレスリリース)