癌抑制タンパク質がポリユビキチン鎖を切断するメカニズム (プレスリリース)
- 公開日
- 2015年02月17日
- BL32XU(理研 ターゲットタンパク)
- BL41XU(構造生物学I)
国立大学法人東京大学
独立行政法人科学技術振興機構
研究成果のポイント
•癌抑制タンパク質CYLDは、免疫応答の促進に関与する2種類のポリユビキチン鎖注1を切断して、過剰な免疫応答を抑える働きがあります。
•CYLDとポリユビキチン鎖とが結合した状態の立体構造を決定し、切断方法を解明しました。
•本成果は免疫応答や炎症反応、腫瘍形成の原因を解明する今後の研究に役立つ知見になると期待されます。
|
東京大学放射光連携研究機構の深井周也准教授らは、癌抑制タンパク質CYLDが、免疫応答の促進に関与する2種類のポリユビキチン鎖を切断する方法を、CYLDとポリユビキチン鎖とが結合した状態の立体構造を決定し、解明しました。 ポリユビキチン鎖注1とは、ユビキチン注2と呼ばれる小さなタンパク質が細胞内でいくつもつながったもので、そのつながりかたの違いによって、制御される生体反応は異なります。このつながりかたは、ユビキチンが次のユビキチンとどの場所でつながるかによって異なり、8種類のつながりかたがあります。このうち、先頭のメチオニン(Met1)でユビキチン同士がつながったポリユビキチン鎖や63番目のリジン(Lys63)でつながったポリユビキチン鎖は、CYLDにより適切に切断されなければ、過剰な免疫応答を引き起こし、腫瘍形成や細胞の癌化へと進展することが知られています。しかし、Met1と、Lys63とでつながったポリユビキチン鎖では、その構造は異なり、CYLDが双方をどのように区別して認識し、切断しているのかは不明でした。 今回、深井周也准教授らは、SPring-8のビームラインBL41XUおよびBL32XUを利用して、CYLDとMet1でつながったポリユビキチン鎖とが結合した状態の立体構造および、CYLDとLys63でつながったポリユビキチン鎖とが結合した状態の立体構造を決定することで、CYLDがそれぞれのポリユビキチン鎖に対応して構造を変化させて、ポリユビキチン鎖を切断していることを明らかにしました。 免疫応答や炎症反応、腫瘍形成、細胞の癌化の原因を解明する今後の研究に役立つ知見になると期待されます。 本成果は、科学技術振興機構(JST)の戦略的創造研究推進事業チーム型研究(CREST)「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域(田中啓二研究総括)における研究課題「シナプス形成を誘導する膜受容体複合体と下流シグナルの構造生命科学」(研究代表者:深井周也)の一環として行われました。 (論文) |
研究の背景
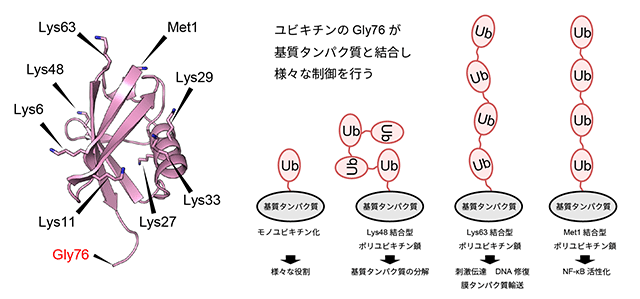
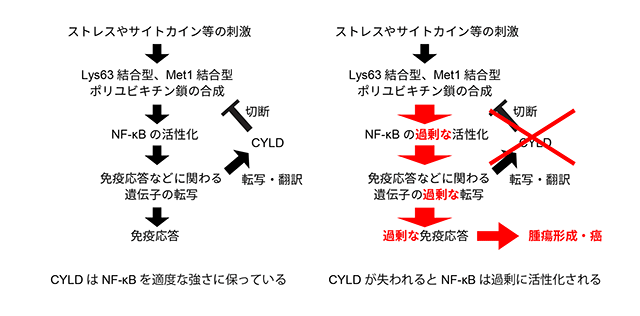
酵母からヒトにいたる真核生物の細胞内では、76個のアミノ酸がつながってできた小さなタンパク質であるユビキチンが、細胞内のさまざまなプロセスを制御しています(図1)。このユビキチンは単独でも働きますが、ユビキチンがいくつも連なって形成されるポリユビキチン鎖もまた、さまざまな生体反応において重要な情報伝達物質として働き、その機能と構造についての知見は近年大きな進歩を遂げています。ポリユビキチン鎖はユビキチンのC末端のグリシン残基と、別のユビキチンのN末端アミノ基、もしくはリジン側鎖のアミノ基が共有結合を形成することで合成されますが、ユビキチンにはポリユビキチン鎖の形成に使われる残基は8種類あり(Lys6, 11, 27, 29, 33, 48, 63及びMet1)、使われる残基によって異なる機能を持ちます(図1)。免疫・炎症反応の過程で多くの遺伝子の発現誘導に関わるNF-κB注3シグナル伝達経路においては、Lys63でつながったポリユビキチン鎖(Lys63結合型ポリユビキチン鎖)と、Met1でつながったポリユビキチン鎖(Met1結合型ポリユビキチン鎖)がこの経路を活性化する情報伝達物質として重要な役割を果たすことが明らかとなっています。一方、家族性円柱腫症注4の原因遺伝子産物として同定された癌抑制タンパク質であるCYLDは、Lys63結合型ポリユビキチン鎖とMet1結合型ポリユビキチン鎖だけを切断(選択的に切断)することでNF-κB経路の活性を抑え、転写を抑制します(図2)。したがってCYLDの機能解明は癌や腫瘍抑制メカニズムの理解につながるものであり、大きな注目を集めていました。しかし、CYLDの働きを理解する上で最も重要であると考えられるポリユビキチン鎖の選択的切断メカニズムの詳細についてはこれまで明らかにされていませんでした。
研究内容
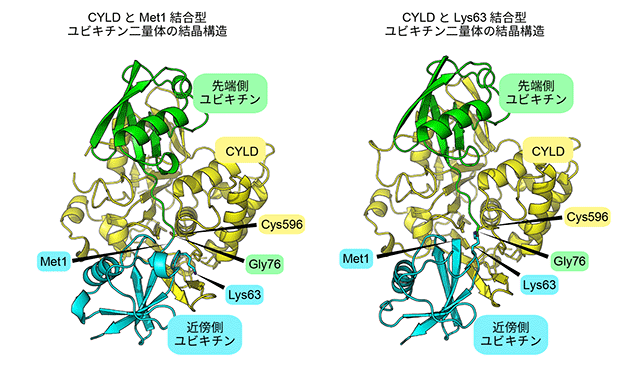
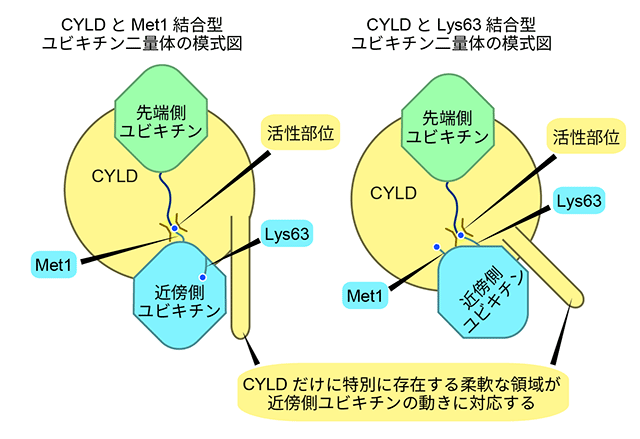
深井周也准教授らはCYLDとMet1結合型ポリユビキチン鎖とが結合した状態の結晶と、CYLDとLys63結合型ポリユビキチン鎖とが結合した状態の結晶をそれぞれ作製し、それらの立体構造を決定しました(図3)。今回作製したポリユビキチン鎖はユビキチンを2つつなげた二量体で、2つのユビキチンのうち、C末端グリシンを使って別のユビキチンに結合している方のユビキチンを先端側ユビキチン、結合されている方のユビキチンを近傍側ユビキチンと呼びます。Met1結合型、Lys63結合型のどちらの複合体でも、CYLDは先端側、近傍側ユビキチンの形を同時に認識し、CYLDの596番目のシステイン(Cys596)がポリユビキチン鎖をちょうど切断する位置にみつかりました。そして、CYLDは近傍側ユビキチンとの結合で、ポリユビキチン鎖がMet1結合型あるいは、Lys63結合型であるかを認識して、切断していることがわかりました。しかし、もちろんMet1結合型とLys63結合型とでは、ユビキチン同士のつながりかたが異なるため、近傍側ユビキチンの向きはMet1結合型とLys63結合型で異なります。しかし、非常に興味深いことに近傍側ユビキチンの向きがMet1結合型とLys63結合型で変わっても、CYLDだけに特別に存在する柔軟な領域が、両型の近傍側ユビキチンと相互作用できるように変化し、それぞれのポリユビキチン鎖を切断できることが明らかになりました。これは、これまでには報告されていない、選択的にポリユビキチン鎖を認識する新規のメカニズムです(図4)。
社会的意義
本研究では、癌抑制タンパク質CYLDによる、Met1結合型およびLys63結合型ポリユビキチン鎖の選択的切断メカニズムを解明しました。8種類存在するポリユビキチン鎖を生命がどのように識別しているのかを明らかにすることで、ポリユビキチン鎖の機能について理解を深めることができます。また、本成果は免疫応答や炎症反応、腫瘍形成、細胞の癌化を解明する今後の研究に役立つと期待されます。
《参考図》
ユビキチンはリジン(Lys)や先頭のメチオニン(Met1)のアミノ酸で次のユビキチンとつながり、ポリユビキチン鎖が作られる。ユビキチン同士がどのアミノ酸でつながるかによって、ポリユビキチンの機能と構造は大きく異なる。
さまざまな刺激によりポリユビキチン鎖が合成され、免疫応答が起こる。CYLDはポリユビキチン鎖を切断することで過剰な免疫反応を抑え、腫瘍形成や癌化を抑制する。
CYLDとLys63でつながったポリユビキチン鎖とが結合した状態の立体構造。どちらの構造でもCYLD(黄色)は先端側ユビキチン(緑)、近傍側ユビキチン(水色)と同時に結合し、切断部分と596番目のシステイン(Cys596)が接近している。2つの構造中で、近傍側ユビキチンの向きだけわずかに異なる。
2つの構造中で、近傍側ユビキチンの向きだけわずかに異なるが、CYLDだけに特別に存在する柔軟な領域が、近傍側ユビキチンの向きが変わっても近傍側ユビキチンと常に結合している。このため、CYLDはMet結合型とLys63結合型ポリユビキチン鎖のどちらも切断することができる。
《用語解説》
注1 ポリユビキチン鎖
複数のユビキチン注2がつながったタンパク質。ユビキチンはメチオニン、もしくはリジン残基に次々とつながって合成される。つながりかたが異なるポリユビキチン鎖が8種類存在し、つながりかたによって機能と構造が大きく異なる。例えば、Lys48でつながると不要になったタンパク質を分解し、Lys63でつながると免疫応答の促進などを行う。
注2 ユビキチン
76個のアミノ酸からなる小さなタンパク質で、C末端のグリシンが標的のタンパク質と結合することで、さまざまな生体反応の目印となる。
注3 NF-κB(エヌエフ・カッパー・ビー)
ストレスやサイトカインなどの刺激を受けると核内へと移行し、免疫応答などに関するさまざまな遺伝子の転写を活性化する大型のタンパク質。
注4 家族性円柱腫症
常染色体優性遺伝による疾患で、円柱腫と呼ばれる良性腫瘍が主として頭皮に生じるもの。
|
《問い合わせ先》 (JST事業に関すること) (SPring-8に関すること) |
- 現在の記事
- 癌抑制タンパク質がポリユビキチン鎖を切断するメカニズム (プレスリリース)