生体内の微量な金属イオンを巧妙に取り込むタンパク質複合体の立体構造を解明(プレスリリース)
- 公開日
- 2015年06月10日
- BL41XU(構造生物学I)
2015年6月10日
京都大学
|
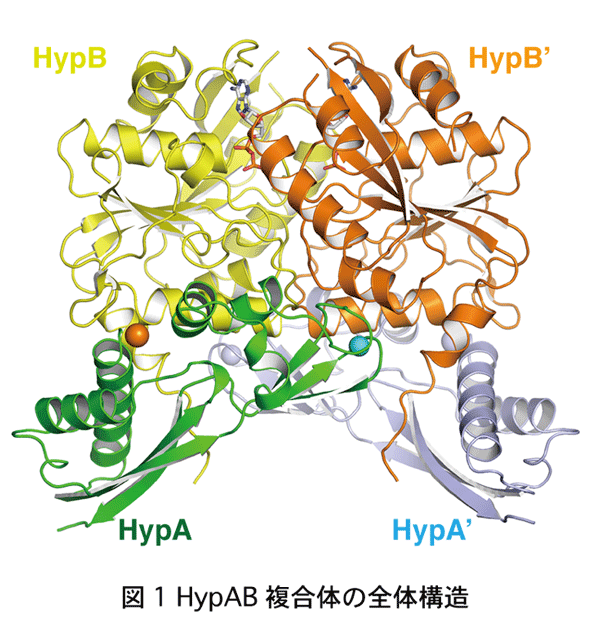
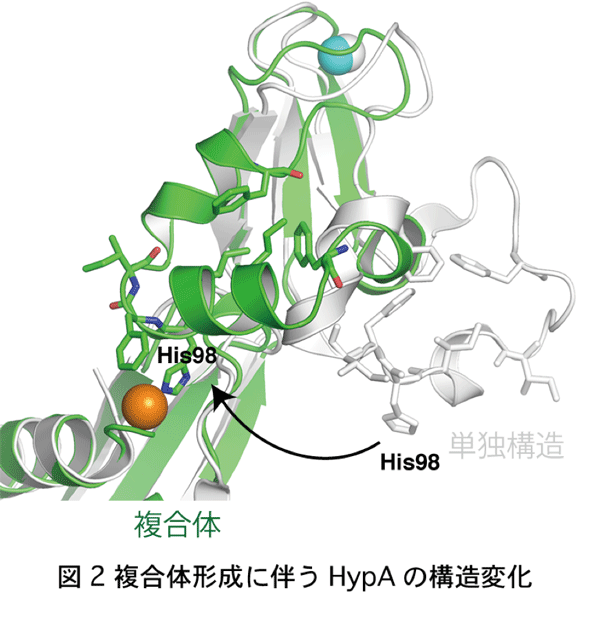
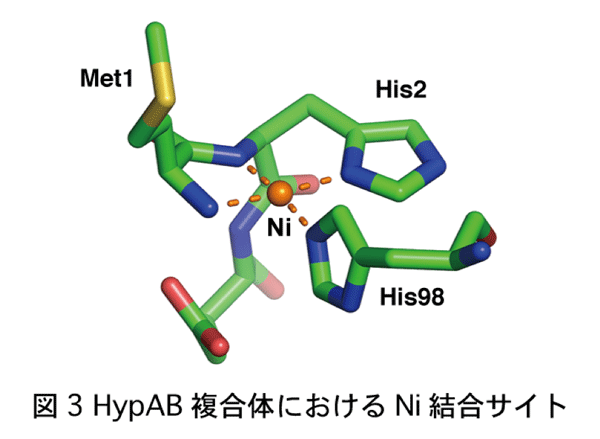
京都大学大学院理学研究科の 三木邦夫 教授、渡部聡 特定研究員(現 東北大学多元物質科学研究所助教)、西谷優一 特定研究員、河島拓未 元大学院生らの研究グループは、同工学研究科の跡見晴幸教授、立命館大学、東北大学との共同研究で、タンパク質複合体の結晶構造に基づいて、水素の可逆的な酸化反応を触媒するヒドロゲナーゼの機能に必要なニッケルイオンを正確に取り込む仕組みを明らかにしました。 細胞内のタンパク質の約半数は、鉄、亜鉛、銅、ニッケルなどの金属イオンを取り込み、金属タンパク質としてさまざまな生体内反応を触媒しています。これらの金属イオンは、生体内で微量しか存在しないため、各金属タンパク質は、メタロシャペロンと呼ばれるタンパク質の助けをかりて、正確かつ効率的に金属イオンを取り込んでいます。しかし、このようなメタロシャペロンが、どのように金属イオンを効率よく獲得してこれを受け渡すかについては、ほとんど明らかになっていませんでした。 研究グループは、水素分子の可逆的な酸化反応を触媒するヒドロゲナーゼに、正確にニッケルイオンを組み込むHypAと、そのパートナー分子であるATP加水分解酵素HypBについて、これらが一時的に形成する複合体の原子分解能での立体構造を、大型放射光施設SPring-8のBL41XU、大学共同利用機関法人 高エネルギー加速器研究機構 物質構造科学研究所 フォトンファクトリー BL1A, AR-NE3Aを用いたX線結晶解析によって解明しました。ヒドロゲナーゼは、次世代のエネルギーと考えられている水素の触媒開発研究において注目されています。HypAはHypBと複合体を形成することによって、その立体構造が大きく変化し、HypAの分子内でニッケルイオンの結合部位が形成されることが分かりました。その結果、ニッケルイオンに対する親和性が約600倍も上昇し、生体内の微量なニッケルイオンを取り込めるようになることが明らかになりました。またHypAとHypBの複合体の形成と解離は、HypBの触媒するATP加水分解サイクルに伴って制御されていることが分かり、HypAがHypBから解離してニッケルイオンに対する親和性が低下することで、ニッケルイオンがヒドロゲナーゼに組み込まれることが示唆されました。 これらの成果は、生物が微量金属イオンを正確に取り込む普遍的な仕組みの解明に大きく貢献すること、ならびに水素エネルギー開発のためのヒドロゲナーゼの応用研究に活用されることが期待されます。 本研究成果は、米国科学アカデミー紀要に掲載されました。 Satoshi Watanabe, Takumi Kawashima, Yuichi Nishitani, Tamotsu Kanai, |
|
<問い合わせ先> (SPring-8に関すること) |
- 現在の記事
- 生体内の微量な金属イオンを巧妙に取り込むタンパク質複合体の立体構造を解明(プレスリリース)