地球の自転周期、タンパク質が原子スケールで記憶(プレスリリース)
- 公開日
- 2015年06月26日
- BL44XU(生体超分子複合体構造解析)
2015年6月26日
自然科学研究機構分子科学研究所
名古屋大学
大阪大学蛋白質研究所
|
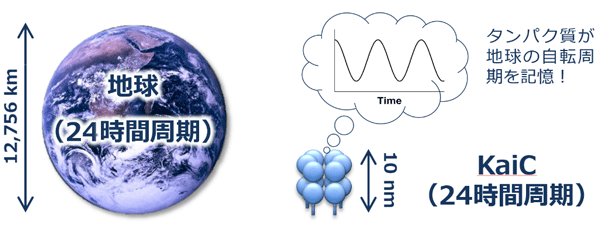
自然科学研究機構分子科学研究所・協奏分子システム研究センターの阿部淳研究員、向山厚助教、秋山修志教授、理論・計算分子科学研究領域の森俊文助教、斉藤真司教授、国立大学法人名古屋大学の近藤孝男特任教授、大阪大学蛋白質研究所の山下栄樹助教らの研究グループは、シアノバクテリアの時計タンパク質※1(KaiC)の立体構造と機能を解明し、わずか10ナノメートルという小さな生体分子に、地球の自転周期(約24時間)を生み出す構造がデザインされていることを突き止めました(図1)。 論文情報 |
研究の背景
多くの生物は、地球の自転に伴う周期的な環境変化(日射強度や温度など)に合わせて自身の生命活動を周期的に調節し、健康的で効率のよい生活を実現しています。生命活動の規模やタイミングを調整するシステムは生物時計と呼ばれ、自律的に約24時間周期で発振する性質を持ち合わせています。バクテリアから哺乳類に至る多様な生物について生物時計の研究が行われ、現在では時計と病気のつがなりが分子レベルで解明されつつあります。一方、「24時間」という周期がどのような仕組みで実現されているのかについては大きな謎とされてきました。
研究グループは、シアノバクテリアの生物時計を対象にこの謎に取り組んできました。シアノバクテリアの生物時計は、3種の時計タンパク質(KaiA、KaiB、KaiC)をATP※2と混ぜ合わせるだけで再構成できます。2007年には、KaiCが水分子を用いてATPを分解する化学反応(ATP加水分解反応、ATPase)が、周期の決定因子と深く関係していることが示されており、生物時計の遅さを生み出す根源がKaiCの構造や機能に秘められている可能性が指摘されてきました。
研究の成果
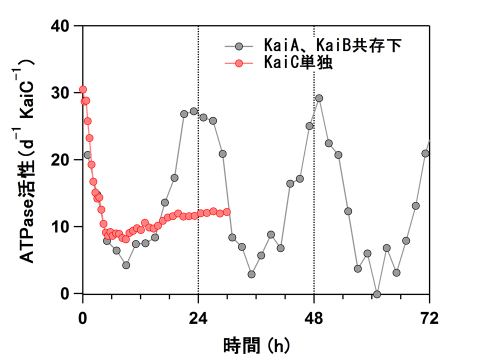
KaiAとKaiBが共存すると、KaiCのATPase活性は24時間周期で安定に振動します(図2)。今回の実験では、KaiC単独であってもATPase活性の時間変化に減衰型の振動成分が確認され、この信号について詳しく検証してみると、24時間周期にほぼ合致する周波数(0.91 day-1)であることがわかりました。この結果は、KaiCに「地球の自転周期」を実装するための「安定した遅さの根源」が存在することを示します。
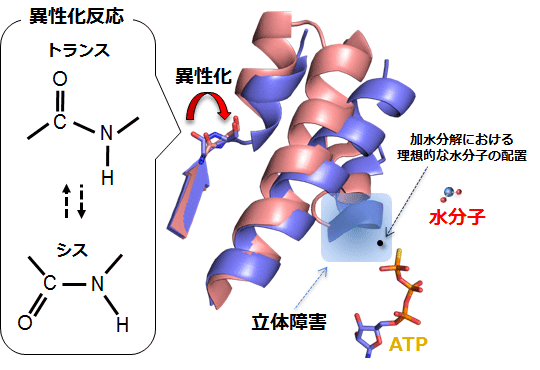
その構造的要因に迫るため、KaiCのN末端ドメインの高分解能結晶構造解析を大型放射光施設SPring-8の大阪大学蛋白質研究所の専用ビームライン(BL44XU)を用いて行いました。我々の解明した原子構造には、「遅さの根源」が浮き彫りとなっていました(図3)。KaiCに結合したATPが容易に加水分解されないよう、リン酸基の近傍には水分子の接近を遮断する障害が設けられ、更に、障害そのものが容易く解除されないよう、あたかも“バネ”のような構造物(ポリペプチド鎖の異性化反応※3)で繋ぎとめられていました。水分子がATPに接近し、異性化反応を伴いつつ加水分解反応を進めるには、とても大きな自由エネルギーを要することが計算機シミュレーション等からも示されました。このような原子スケールの制御により、KaiCのATPase活性は他のタンパク質に比べて102 - 106倍も低く抑えられていることが明らかとなりました。
立体障害のため、効率よく加水分解が起こる位置(黒丸)に水分子が侵入できない。
生物時計には、周期を温度に対してほぼ一定に保つ性質(温度補償性)が備わっています。KaiCはATPを個別に結合できる6個のサブユニットで構成されていますが、上記のような原子スケールの制御が6量体内で非対称的に作用することで、ATPase活性を低く一定値に保つためのフィードバック制御を実現しています。このようなタンパク質構造を介したフィードバック制御の時定数として、地球の自転周期(24時間)が書き込まれていることが明らかとなりました。
この研究の社会的意義
KaiCを含めたタンパク質分子は、本来、より速い時間スケール(10-12秒~10-1秒)で運動することができます。本研究成果は、運動や反応の効率を抑制制御することで、小さなタンパク質分子に24時間のタイムスケールを実装させることができることを原子レベルで明らかにした例です。また、その制御に「水分子」「ATP」「ポリペプチド鎖」といった生物界に普遍的に存在する物質が用いられている点は、ヒトを始めとする高等生物においても類似の分子機構が存在する可能性を予期させます。一方、細胞内の込み入った雑音の多い環境下で、KaiCは僅かなATP消費エネルギーで時刻情報を長期にわたって記憶します。この自然の叡智は、持続可能で高効率な化学反応、分子システムによる情報処理、省エネ・環境低負荷型デバイス、などの実現に指針を与えるものと期待されます。
《用語説明》
(1) 時計タンパク質
生物時計としての機能を維持するために必須となるタンパク質の総称。時計タンパク質の変異や欠損により、生物のさまざまな行動において、リズム特性が変調を受ける。
(2) ATP
アデノシン三リン酸(Adenosine Triphosphate)のことで、筋肉が収縮するときなどにエネルギー源として利用される物質。生物体におけるエネルギー利用や保存に際して用いられるヌクレオチドであり、その存在量や物質代謝における重要性から「生体のエネルギー通貨」とも呼ばれる。アデノシンという物質に3つのリン酸基が結合した形をしているが、ATP加水分解酵素の働きによって、リン酸基が外されて分解される。1つのリン酸基がはずれる毎に、約8kcal/molのエネルギーを放出する。
(3) ポリペプチド鎖の異性化反応
タンパク質のポリペプチド主鎖の異性化反応。秒よりも長い時間スケールで進行することが多く、生体内で起こる遅い反応のひとつである。機能を保持したタンパク質構造において主鎖は通常トランス型であり、シス型が安定に見つかることはごく稀である。
研究サポート
本研究は科学研究費補助金No.22687010, No.24000016等および文部科学省創薬等支援技術基盤プラットフォームの支援を受けて行われました。
|
《問い合わせ先》 (SPring-8に関すること) |
- 現在の記事
- 地球の自転周期、タンパク質が原子スケールで記憶(プレスリリース)