ハタ科魚類のウイルスの構造を解明(プレスリリース)
- 公開日
- 2015年11月12日
- BL12B2(NSRRC BM)
- BL44XU(生体超分子複合体構造解析)
このプレスリリースはNational Synchrotron Radiation Research Center (NSRRC)の発表記事を日本語翻訳したものです。詳しくはこちらのページをご覧ください。
|
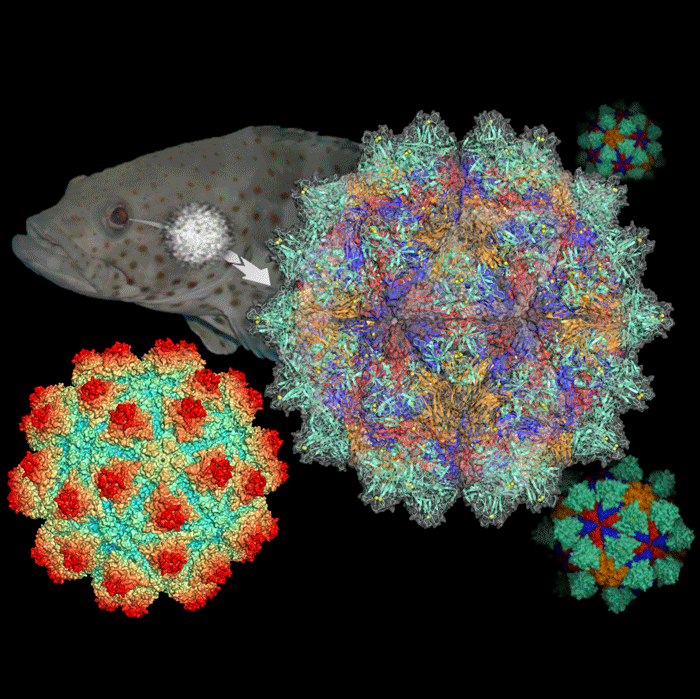
台湾のNational Synchrotron Radiation Research Center (NSRRC)、National Cheng Kung University(NCKU)の研究チームがハタ科魚類に感染して死に至らしめるウイルスの構造を世界で初めて解明しました。NSRRCのChun-Jung Chen博士、博士課程のNai-Chi ChenとNCKUのTzong-Yueh Chen博士はSPring-8と台湾の放射光施設Taiwan Light Source(TLS)を利用して、ハタ科神経壊死症ウイルス Grouper Nervous Necrosis Virus (GNNV)の3次元の結晶構造を決定し、そのウイルス粒子の表面に特異な突起ドメインがあることを発見しました。この新しい研究結果は専門誌、PLOS Phathogensに公開されています。 <発表論文> |
放射光が見えないものを明らかにする。
台湾ではハタの養殖業が盛んで主な輸出品目であり、年間2,500トンの生産量があり80億円NTドル(300億円相当)の産業となっています。 しかし、近年ハタ科ウイルスの感染拡大が起こり甚大な被害を招いています。
研究チームはSPring-8のBL12B2、BL44XUビームラインを用いたX線結晶構造解析により、ハタ科ウイルスの表面が60個の大きな突起ドメインで対称に覆われていることを発見しました。突起ドメインは三つのキャプシド蛋白質から構成されていました。この突起ドメインが、このウイルスの複雑な感染のしくみを理解するカギとなります。この発見によって、どのようにしてウイルス感染時に突起ドメインが“鍵”となって魚の細胞膜レセプターに反応するのかが理解可能になると期待されます。
放射光X線は通常のⅩ線装置に比べて1000倍明るく、X線結晶構造解析は電子顕微鏡よりも10倍高い空間分解能を持っています。研究チームは0.36nm(3.6Å)(髪の毛の直径の0.00003%)の原子分解能でウイルスの構造を解析できました。Chun-Jung Chen博士は、「放射光の光のおかげで見えない”鍵”が見えるようになった」と言っています。
新しいワクチンが魚の養殖に大進歩をもたらす。
ハタは経済的価値が高いのですが、たびたびウイルス感染や災害などの害に悩まされています。そのため、稚魚の1%しか成魚にまで成長できません。現在売られているワクチンは値段が高い上に、このウイルスに対する特異性もないのであまり効きません。
Tzong –Yueh Chen博士は 、「これまで、このウイルスはおぼろげな電子顕微鏡像しかなく、高い特異性をもったワクチンを開発するのに充分な情報が得られませんでした。この詳細な鍵となる構造を抗原決定基として、より効率的にハタ科魚のウイルス感染を防ぐワクチン開発をすることができるでしょう」とコメントしています。 「長い期間にわたる研究のなかで一番重要で難しかったのは、良質のウイルス結晶を成長させることでした。まるで子供を育てるかのように多大な忍耐と注意が必要でした。良質の結晶を得るのに5年かかりましたが、ついに高分解能の回折データが得られました」とNai-Chi Chen氏は言っています。
生命科学のための放射光
Chun-Jung Chen博士は、「放射光のX線と蛋白質結晶学の組み合わせが、この大きく複雑なウイルスの構造を決定するのに決定的な役割を果たしました。このGNNV粒子の直径は30nmで通常の蛋白質より10倍も大きいため、このように大きく良質の結晶を成長させるが困難であっただけでなく、それから高分解能なデータを取るには強いX線が必要でした」と付け加えました。放射光は、小さい結晶や質の充分でない結晶からでも構造解析を可能とし、さらに構造を効率よく解くことで研究スピードを加速しています。
図2:(左)ハタ科神経壊死ウイルス(GNNV)の結晶。
(右)ハタ科神経壊死ウイルス(GNNV)の表面全体に対称に散らばっている突起ドメイン(赤色で示している)。
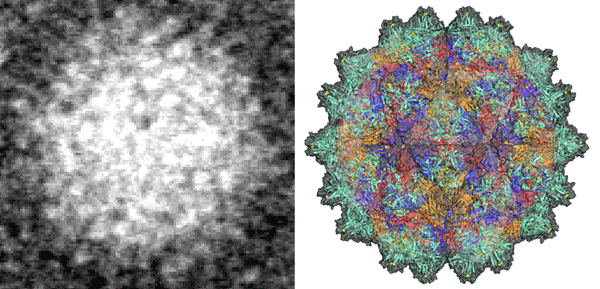
図3:(左)電子顕微鏡による不明瞭な像。
(右)放射光によるウイルスの原子分解能の精細な構造。
図4:(左)SPring-8 BL12B2の蛋白質結晶構造解析ステーション。
(中)台湾放射光(Taiwan Light Source)での蛋白質結晶解析用エンドステーション。
(右)蛋白質結晶学の研究室。
|
【お問い合わせ先】 (SPring-8に関すること) |