小さなRNAが生殖細胞を守るメカニズムの一端を解明(プレスリリース)
- 公開日
- 2016年09月30日
- BL41XU(構造生物学I)
2016年9月30日
国立大学法人東京大学
発表のポイント
・小分子RNA(piRNA)はPIWIタンパク質と複合体を形成し、動物の生殖細胞のゲノム情報を守る役割をもつ。
・PIWI-piRNA複合体の立体構造を世界で初めて解明した。
・piRNAの機能異常は不妊を引き起こすことが知られており、本研究成果はヒトの不妊発症機構の理解にもつながることが期待される。
piRNAとよばれる約30塩基長の小分子RNAはPIWIタンパク質と結合し、生殖細胞のゲノムDNAを保護する役割を担っています。しかし、PIWI-piRNA複合体がはたらくメカニズムには不明な点が多く残されていました。今回、東京大学大学院理学系研究科の松本直樹大学院生(研究当時)、西増弘志助教、濡木理教授、塩見美喜子教授を中心とする研究グループは、カイコに由来するPIWIタンパク質(Siwi)を精製し、その結晶構造を世界で初めて解明することに成功しました。その結果、SiwiがpiRNAと結合して生殖細胞を守るメカニズムの一端が明らかになりました。線虫からショウジョウバエ、魚、ヒトに至る多くの生物においてpiRNA経路の異常は不妊につながることが知られています。したがって、本研究の成果はpiRNA経路の理解にくわえ、ヒトの不妊発症のメカニズムの解明にもつながることが期待されます。 発表雑誌: |
発表内容:
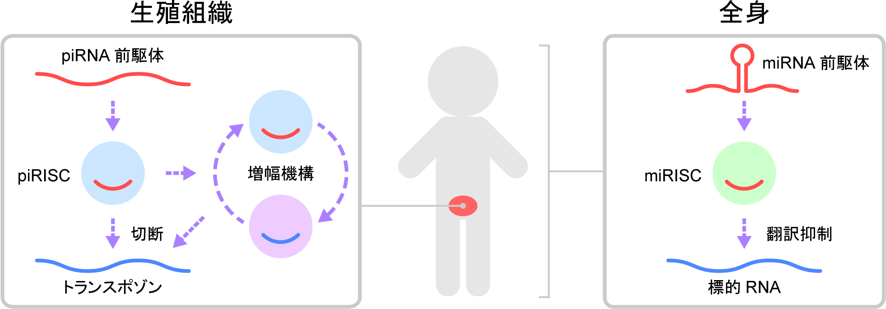
近年、小さなRNAが多岐にわたる生命現象に関与していることが明らかになってきました。小分子RNAはArgonauteタンパク質とRISC(RNA-induced silencing complex)を形成し、遺伝子のはたらきを制御する役割をもちます。RISCは小分子RNAを利用して標的RNAをみつけだし、切断や翻訳抑制を引き起こします(図1)。ArgonauteはAGOタンパク質とPIWIタンパク質に大別されます。AGOタンパク質はさまざまな組織に広く発現し、約22塩基長のsiRNA(small interfering RNA)やmiRNA(microRNA)に結合し、特定の遺伝子の発現を抑制するはたらきをもちます。一方、PIWIタンパク質は主に動物の生殖組織に発現し、23–33塩基長のpiRNA(PIWI-interacting RNA)に結合し、トランスポゾン(注1)に由来するRNAを切断することにより、ゲノム情報を次世代に正確に伝える役割を担っています。
Argonauteは4つの機能ドメイン(N、PAZ、MID、PIWI)とそれらをつなぐリンカードメインから構成されます。これまでにAGOタンパク質の立体構造が複数決定され、小分子RNAの認識機構や標的RNAの認識・切断機構など、AGOタンパク質の作動原理の理解が進んできました。一方、PIWIタンパク質の立体構造は不明であり、PIWIタンパク質によるトランスポゾン抑制機構の理解は遅れていました。一般的に結晶構造解析には大腸菌や昆虫細胞などを用いて大量に合成した組換えタンパク質(注2)が利用されます。しかしながら、組換えPIWIタンパク質の調製は困難であり、試料調製が結晶構造解析の大きな障壁となっていました。
今回、本研究グループはカイコの卵巣に由来するBmN4培養細胞(注3)に着目しました。先行研究から、BmN4細胞にはPIWIタンパク質のひとつであるSiwiが発現していることが明らかになっていました。さらに、Siwiに特異的に結合する抗体も報告されていました。試行錯誤の末、この抗体を利用することにより、BmN4細胞の抽出液からpiRNAと結合した状態のSiwiを精製することに成功しました。さらに高純度に精製したSiwi-piRNA複合体を結晶化し、大型放射光施設SPring-8(注4)のビームラインBL41XUにおいてX線回折データを収集し、その結晶構造を決定することに成功しました。
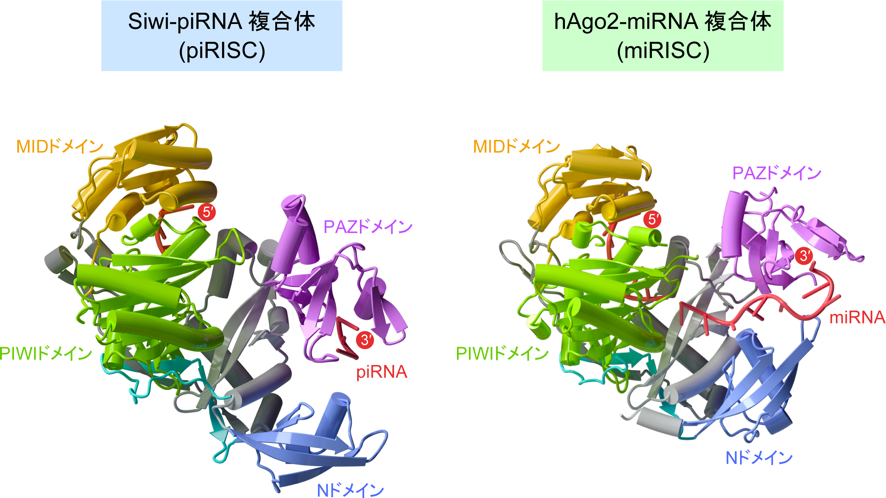
SiwiはAGOタンパク質と同様に2つのローブ(注5)(N-PAZローブ、MID-PIWIローブ)から構成され、その間にpiRNAが結合していることが明らかになりました(図2)。これまでに詳細に研究されているhAgo2(ヒト由来AGOタンパク質)とSiwiの立体構造の比較から、それぞれのドメインの構造はよく似ている一方、NドメインとPAZドメインの配向が異なることが明らかになりました(図2)。PIWIタンパク質とAGOタンパク質では、結合する小分子RNAの長さやRISCの形成機構が異なることが知られています。さらに、最近の研究から、標的RNAを切断したのち、Siwiでは切断産物がとどまるのに対し、ヒトやショウジョウバエのAGOタンパク質では切断産物が放出されることがわかっています。これはAGOタンパク質による切断産物は単なる分解産物にすぎない一方で、Siwiによる切断産物はpiRNA前駆体として再利用されることを反映していると考えられています。したがって、今回明らかになった立体構造の違いがこのような機能の違いを生み出している可能性が示唆されました。
本研究の成果は生殖細胞におけるpiRNAを介したトランスポゾン抑制機構の解明につながると期待されます。またショウジョウバエやマウスにおいてpiRNA経路の破綻は卵形成や精子形成の異常をまねき、不妊を引き起こすことがわかっています。したがって、piRNA経路の理解はヒトの不妊発症機構の解明などの応用にもつながることが期待されます。
本研究は、日本学術振興会 基盤研究(B)「RNAサイレンシングの分子機構の解明」(研究代表者:西増 弘志)、日本学術振興会 新学術領域研究「立体構造から理解するRNAタクソノミ」(研究代表者:西増 弘志)、AMED-CREST「慢性炎症による疾患発症機構の構造基盤」(研究代表者:濡木理)、日本学術振興会 基盤研究(S)「霊長類を含む哺乳動物の生殖エピゲノム形成機構」(研究代表者:塩見春彦)、日本学術振興会 基盤研究(S)「トランスポゾン侵略から生殖細胞ゲノムをまもるpiRNA動作原理の統合的理解」(研究代表者:塩見美喜子)の支援を受けて行われました。
【参考図】
AGOタンパク質とPIWIタンパク質は発現組織、RISC形成機構、作動機構などの点で異なる。AGOタンパク質はmiRNAとmiRISCを形成し、miRNAと相補的な塩基配列をもつ標的遺伝子の翻訳を抑制する。一方、PIWIタンパク質はpiRNAとpiRISCを形成し、トランスポゾンの転写産物を分解する、あるいは、転写を抑制することによってその発現を抑制する。piRNAはトランスポゾンに相補的な塩基配列を有するため、これを特異的に抑制することができる。
SiwiとhAgo2において、MID-PIWIローブに対するNドメインおよびPAZドメインの配置が顕著に異なることがわかる。電子密度が観察されなかったpiRNAの中央部分は柔軟な構造をとっていると考えられる。
【用語解説】
注1 トランスポゾン
ゲノム上を動く遺伝子。トランスポゾンの転移は遺伝情報の破壊につながる可能性をもつ一方で、生物の進化に寄与したとも考えられている。
注2 組換えタンパク質
遺伝子工学的手法により大腸菌や昆虫細胞などの宿主細胞を用いて人為的に合成したタンパク質。
注3 BmN4細胞
カイコの卵巣に由来する培養細胞。piRNA経路の研究材料として利用されている。
注4 SPring-8
兵庫県にある世界最大級の大型放射光施設。高輝度のX線を用いた実験が可能である。
注5 ローブ
タンパク質分子中の機能的なかたまり。
【問い合わせ先】 (報道に関すること) (SPring-8に関すること) |
- 現在の記事
- 小さなRNAが生殖細胞を守るメカニズムの一端を解明(プレスリリース)
 bs.s.u-tokyo.ac.jp
bs.s.u-tokyo.ac.jp