微小タンパク質結晶からの効率的な構造解析法 -凍結した試料を回転させる「SS-ROX法」を確立、汎用化へ-(プレスリリース)
- 公開日
- 2017年01月05日
- BL41XU(構造生物学I)
2017年1月5日
理化学研究所
高輝度光科学研究センター
京都大学
|
理化学研究所(理研)放射光科学総合研究センター生命系放射光利用システム開発ユニットの山下恵太郎基礎科学特別研究員、山本雅貴ユニットリーダー、高輝度光科学研究センター タンパク質結晶解析推進室の長谷川和也チームリーダー、熊坂崇室長代理、京都大学大学院薬学研究科の中津亨准教授らの共同研究グループ※は、放射光を利用して数マイクロメートル(μm、1μmは100万分の1メートル)程度の微小タンパク質結晶から効率よく回折データを得る「Serial Synchrotron Rotation Crystallography(SS-ROX)法」の測定技術を確立しました。 論文情報 |
背景
タンパク質X線結晶構造解析法は、高い分解能で生体分子の構造を決める最も一般的な方法です。これまで全世界で10万種類以上のタンパク質の構造決定に用いられました。しかし、近年はその構造解析の対象が、サイズが大きい良質な結晶を得ることが難しい疾病原因タンパク質などへ変わってきています。それらの微小結晶から高精度な回折データを得るには、SPring-8などの放射光施設の高輝度マイクロビームを用いた測定が有効です。一方で、この測定では放射線損傷により結晶の品質が低下し回折能が低下することから、それらの小さな結晶一つから構造解析に必要な数百~数千枚の回折像を得ることが難しくなってきました。そのため、多数の結晶から得た部分的なデータを合わせて完全性を高める必要があります。
10マイクロメートル(μm、1μmは100万分の1メートル)程度の結晶であれば、それぞれの結晶から数十枚の回折像を得ることができるため、数十個の結晶を用意し、各結晶の測定位置を決めた上で測定すれば、数百~数千枚の回折像を得ることができます。しかし、より小さな数μmサイズの結晶では、一つの結晶から1~数枚の回折像しか得られないことが多く、結晶を数百~数千個用意する必要があります。このため、より効率的な測定方法の開発が求められていました。
微小結晶からのデータ測定には「連続フェムト秒結晶構造解析(SFX)法[6]」も利用されています。SFX法はX線自由電子レーザー(XFEL)[7]を用いた解析法です。室温で時間分解能の高いフェムト秒(1フェムト秒は1000兆分の1秒、10-15秒)の極短パルスを利用する測定のため、タンパク質の働く様子の“動的な構造解析”が可能です。しかし、現状ではXFEL施設が世界に日本と米国の二箇所にしかないことから、測定の機会が限られています。また、SFX法では放射光施設の高輝度マイクロビームを用いた測定と比較すると、より多くの試料が必要です。
そこで共同研究グループは、SPring-8の高輝度マイクロビームと凍結固定した微小結晶を用いて、少ない試料で微小タンパク質の構造を決定できる高分解能な“静的な構造解析”を可能にする新たな測定方法の開発を進めてきました。
研究手法と成果
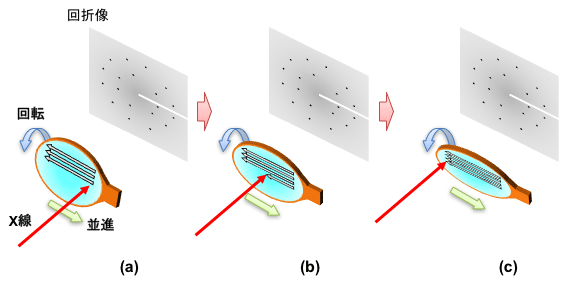
共同研究グループは、高輝度マイクロビームを用いて微小なタンパク質の結晶を効率よく解析するために、「Serial Synchrotron Rotation Crystallography (SS-ROX)法」に着目しました(図1)。SS-ROX法では、樹脂製の直径約1mmのサンプルループで目標の微小結晶を含んだ懸濁液をすくい上げ、それを凍結したものを試料として実験装置に載せます。
従来の測定では、結晶の位置を合わせ固定した後でX線を照射しますが、SS-ROX法ではサンプルループを動かすことでループ内の試料へ網羅的にX線を照射し、凍結した懸濁液に含まれる微小結晶を効率的にスキャンします。また、試料を数十ミリ~数百ミリ秒間X線で“露光”する間にサンプルループを回転させることで照射範囲が大きくなり、回折強度の精度が向上し、回折像1枚あたりに含まれる結晶構造の情報が増えると考えられます。
樹脂製の直径約1mmの楕円形をしたサンプルループ(茶色)にすくい上げた目的の微小結晶を含んだ懸濁液(水色)を、緑矢印方向に並進、青矢印方向に回転させながらX線(赤矢印)を照射する。照射はサンプルループの右端から開始され(a)、左端で終了する(c)。その後、サンプルループを縦方向にずらし、次の行に対して同様のX線照射を行う。これを一つの試料あたり数十回繰り返す。すると、サンプルループ中の微小結晶に網羅的にX線を照射することになり、効率のよい回折データ測定が可能となる。
その一方で、SS-ROX法はSFX法のように、放射線損傷が生じる前にデータ取得が可能な“Diffraction before destructionの原理”に基づいた測定法ではないため、試料が無損傷であることが明らかではありません。そこで、放射線損傷の影響を評価し、SS-ROX法の測定技術を確立することが必要でした。
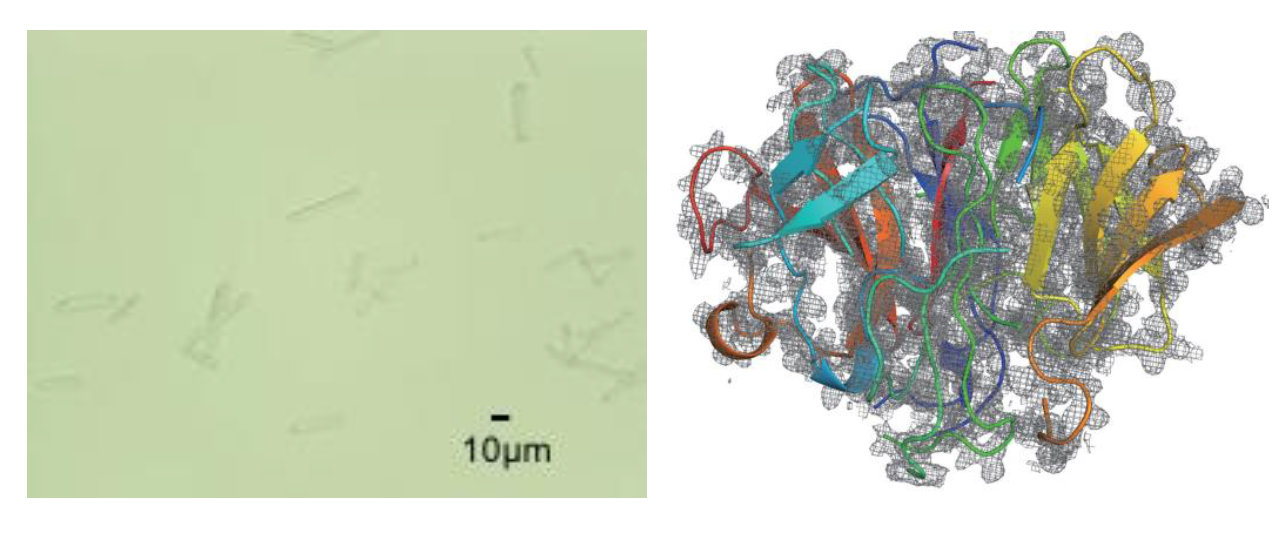
共同研究グループは、ルシフェリン再生酵素(LRE)の水銀誘導体の微小結晶(図2左)を用いて、SPring-8の構造生物学用ビームラインの一つであるBL41XUでSS-ROX法による測定を行いました。1枚の回折像を得るにあたって、試料の回転角度を0°~2°に変えてデータ測定を行いました。その結果、静止写真(回転角度0°の測定)では構造決定に17,800枚の回折像が必要だったのに対し、1°以上回転させると400~600枚の回折像で構造決定できました(図2右)。
左:LREの微小結晶の光学顕微鏡写真。細長い棒状の結晶がLREである。
右:SS-ROX法により得られたLREの電子密度図(灰色)と立体構造(リボン図)。
また、この測定に使用した試料の量はわずか数マイクログラム(μg、1μgは100万分の1グラム)で、SFX法の約100分の1の量で済みました。さらに、露光時間を変えながら放射線損傷の影響について調べたところ、LREでは吸収線量3Mグレイ(Gy、1MGyは100万グレイ)までであれば、放射線損傷による劣化のデメリットよりも長時間露光によって得られるS/N比向上のメリットの方が大きいことが分かりました。
以上の結果により、共同研究グループが、少ない試料でタンパク質微小結晶から構造を決定できるSS-ROX法の測定手法を確立したことが示されました。
今後の期待
共同研究グループは、これまでに高輝度マイクロビームラインやそれを用いたデータ測定法の開発を行い、SPring-8での微小結晶の測定を実現してきました。今回確立したSS-ROX法は、微小結晶構造解析の効率化を達成し、従来法では困難だったより小さい結晶の利用も実現できます。また、SPring-8のような高輝度放射光施設に設置されたマイクロビームが利用できるビームラインであれば、世界中どこでも適用可能な測定手法であることから、SS-ROX法は微小結晶の汎用的なデータ測定方法になると期待できます。
近年、創薬ターゲットとなるタンパク質では大きいサイズの良質な結晶が得にくくなっています。今後SS-ROX法と、XFELでのSFX法による動的構造解析を相補的に組み合わせることで、微小結晶からの効率的な構造解析とドラッグスクリーニングへの貢献が期待できます。
補足説明
[1] タンパク質X線結晶構造解析法
タンパク質の結晶にX線を照射して得られる回折像からタンパク質の立体構造を決定する手法。結晶中には周期的にタンパク質の粒子が配列しているため、その散乱パターンは規則的な間隔で並ぶ斑点状になる。各回折斑点の強度はタンパク質の立体構造を反映しているため、それぞれの強度を精度よく測定することが構造解析において重要である。
[2] SPring-8
理研が所有する兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す施設。その運転管理と利用者支援は高輝度光科学研究センターが行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。タンパク質の結晶構造解析の分野でも、大きな成果を上げている。
[3] 放射線損傷
X線照射により生じるタンパク質結晶の品質の劣化のこと。回折能の低下や格子定数の変化などの全体的損傷と、ジスルフィド結合の解離などの局所的損傷の二つに大別できる。いずれも、X線照射中に結晶が受ける吸収線量(単位重量あたりに吸収するエネルギー。単位はグレイ(Gy=J/kg)に依存する。凍結結晶の場合20 MGyで回折強度が半分になることが知られている。それに対して局所的な損傷は、もっと低い吸収線量で生じるが、どの程度で起きるかは損傷の種類や周辺の環境によっても異なる。いずれの損傷も構造解析に影響を及ぼすため、回折データ測定において注意が必要である。
[4] ルシフェリン再生酵素(LRE)
蛍の発光に関わるタンパク質。蛍の発光は、ルシフェラーゼというタンパク質がルシフェリンという基質に作用してオキシルシフェリンに変化することで生じる。ルシフェリン再生酵素は、オキシルシフェリンをニトリル体に変換することで、元のルシフェリンの再生を手助けするタンパク質である。LREはLuciferin-regenerating enzymeの略。
[5] S/N比
一般的には測定時の信号(signal)と雑音(noise)の比率を示す。本研究では、構造解析のために利用する結晶からの回折線の信号と解析の妨げとなる結晶以外からの寄生散乱により生じる雑音の比率を指す。S/N比が大きなほど、精度の高い測定データが得られる。
[6] 連続フェムト秒結晶構造解析(SFX)法
多数の微結晶を含む液体などをインジェクターと呼ばれる装置から連続的に供給し、フェムト秒のX線レーザーパルスを照射して結晶構造を解析する手法。配向の異なる多数の微小結晶からの回折データを連続的に収集する。SFXは、Serial Femtosecond Crystallographyの略。
[7] X線自由電子レーザー(XFEL)
近年の加速器技術の発展によって実現したX線領域のパルスレーザー。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とするため、原理的な波長の制限がない。XFELはX-ray Free Electron Laserの略。
|
発表者・機関窓口 高輝度光科学研究センター タンパク質結晶解析推進室 京都大学大学院 薬学研究科 <機関窓口> (SPring-8 / SACLAに関すること) |
- 現在の記事
- 微小タンパク質結晶からの効率的な構造解析法 -凍結した試料を回転させる「SS-ROX法」を確立、汎用化へ-(プレスリリース)
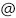 spring8.or.jp(山下)、yamamoto
spring8.or.jp(山下)、yamamoto