貧血予防に新たな指針 ~ ビタミンCが鉄分の吸収を促進するメカニズムを原子レベルで解明 ~(プレスリリース)
- 公開日
- 2018年08月20日
- BL32XU(理研 ターゲットタンパク)
2018年8月20日
公立大学法人兵庫県立大学
国立研究開発法人理化学研究所
国立大学法人島根大学
メリーランド大学
ブリティッシュコロンビア大学
すべての生物の生命維持には「鉄」が必要です。ヒトの体内には、釘1本分(約5 g)の鉄がイオンとして存在し、様々な生体機能の調節に使われています。この鉄は、食物に含まれる鉄イオンを十二指腸の柔毛で吸収することで得られることは古くから知られていましたが、詳細なメカニズムは不明でした。兵庫県立大学大学院生命理学研究科の澤井仁美助教と理化学研究所放射光科学研究センターの杉本宏専任研究員を中心とした共同研究グループは、大型放射光施設「SPring-8」[1]を利用して、ヒトの鉄吸収メカニズムに関わる膜タンパク質の立体構造を世界で初めて解明しました。さらに、その立体構造に基づく機能解析により、食物に含まれるビタミンCや有機酸が鉄分の吸収効率を向上させる仕組みを原子レベルで明らかにしました。本研究の成果は、2018年8月17日付で、Nature Publishing Groupが発行する国際生物科学雑誌『Communications Biology』に掲載されました。 論文情報 |
研究の背景
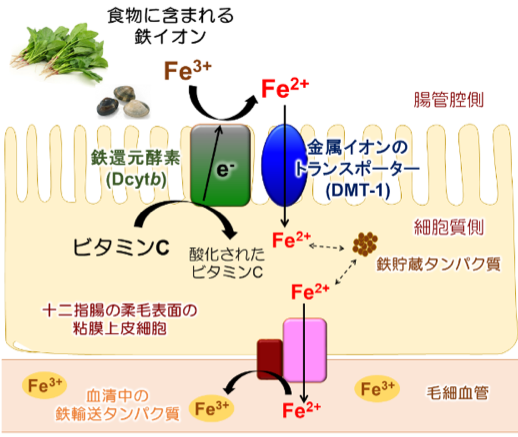
ヒトにとって「鉄」は必要不可欠な栄養素です。私たちは、食物に含まれる鉄イオンを十二指腸で吸収し、酸素の運搬貯蔵・呼吸によるエネルギー獲得・遺伝子の合成・毒素の分解などの重要な生理機能に用いています。ヒトの体内には約5 gの鉄イオンが存在します。毎日そのうちの1~2 mgが、排泄・皮膚の剥離・脱毛などにより失われてしまいますが、失った鉄イオンは日々の食事から補えます。これにより、私たちは体内の鉄イオン濃度を一定に保っています。しかし、十分に食事をとることができない、あるいは食物中の鉄分が不足していた場合は体内の鉄イオンが少なくなってしまい、鉄欠乏性貧血に陥ります。鉄欠乏性貧血は、世界人口の約30%以上(20億人以上)にみられる深刻な栄養問題です。その予防や治療のためには、食物に含まれる鉄イオンを効率よく吸収する方法を見出すための情報が必要です。研究開始当時、図1のような膜タンパク質を介した鉄イオンの吸収メカニズムが明らかになっていました。鉄イオンの吸収に関わる膜タンパク質は、「食物中の鉄イオン(Fe3+)を還元する酵素Dcytb」とDcytbによって「還元された鉄イオン(Fe2+)を細胞内に取り込むトランスポーターDMT-1」の2種類です。食物に含まれる鉄イオンのほとんどがFe3+の状態で存在していますが、DMT-1がFe2+しか輸送できないため、DcytbがFe3+をFe2+に変換する重要な役割を担っています。本研究グループは、ヒトの十二指腸における鉄イオンの吸収メカニズムをさらに詳細に理解するために、鉄イオンの吸収に重要な鉄還元酵素Dcytbの立体構造や機能メカニズムを明らかにすることを目指しました。
食物中の鉄イオンの多くはFe3+で存在しますが、細胞内へ鉄イオンを輸送するタンパク質DMT-1がFe2+しか輸送できないため、鉄還元酵素Dcytbを用いてFe3+をFe2+に還元してから細胞内に運ばれます。取り込まれた鉄イオンは、細胞中では鉄貯蔵タンパク質に蓄えられ、必要に応じて毛細血管へと輸送されます。毛細血管中の鉄イオンは、血清タンパク質と結合し血流にのって全身をめぐります。
研究の手法と成果
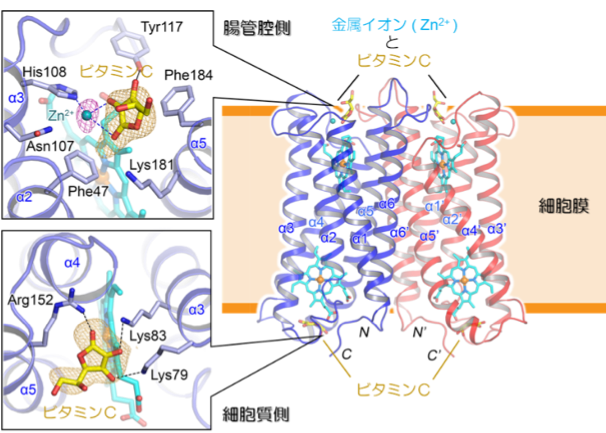
本研究グループは、Dcytbの鉄還元メカニズムを解明するために、高純度なヒト由来Dcytbを調製し、脂質キュービック相法[2] により脂質環境中でDcytbの結晶を作りました。その結晶に大型放射光施設「SPring-8」の理研マイクロフォーカスビームラインBL32XUの高輝度なX線ビームを照射して測定したデータを解析することにより、世界で初めてヒト由来Dcytbの立体構造を解明しました(図2)。Dcytbは6本のαヘリックス構造(図2のα1からα6)からなる単量体が2つならんだホモ二量体[3] を形成しており、単量体あたり2分子のヘム[4]を含んでいました。ビタミンC[5]と金属イオン(Fe3+の代わりに加えたZn2+)は、Dcytbの腸管腔側に面した部分に結合していました(図2の上の吹き出し)。この構造から、DcytbはFe3+だけでなくビタミンCを協働的に結合することが明らかになりました。また、Dcytbの細胞質側にもビタミンCが結合しており(図2の下の吹き出し)、Fe3+の還元に用いられる電子は、ビタミンCから供給され、タンパク質中を通って腸管腔側のFe3+へと伝達されることがわかりました。 さらに、これらの構造情報に基づく機能解析により、ビタミンCだけでなく食物に含まれる有機酸(クエン酸やリンゴ酸など)もFe3+とともにDcytbに結合し、Fe3+の還元反応を促進することを見出しました。
Dcytb はホモ二量体を形成しており、単量体あたり2分子のヘム(シアン色のスティックで表示)を含んでいました。各単量体は6本の膜貫通ヘリックス (α1 - α6) からなり、N末端とC末端は細胞質側に向いていました。ビタミンCは細胞質側と腸管腔側に結合しており、腸管腔側のビタミンCは金属イオンと協働的にDcytbに結合していました(上の吹き出し)。
この研究の社会的意義と今後の展望
鉄欠乏性貧血は、発展途上国における食料不足を原因とするだけでなく、先進国においても過度の減量などにより発症頻度が高く、世界的な栄養問題として早急な予防対策が望まれています。本研究でビタミンCやクエン酸などが鉄イオンの吸収に必須の反応を促進する仕組みを原子レベルで解明したことは、鉄分の効率的な摂取方法や鉄代謝異常による疾病への理解につながり、世界人口の約30%以上(20億人以上)を苦しめる鉄欠乏性貧血の予防や治療の端緒を拓くと考えています。
用語解説
[1]SPring-8:
大型放射光施設「SPring-8」は兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す理化学研究所の施設。SPring-8の名前はSuper Photon ring-8 GeV(80億電子ボルト)に由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する強力な電磁波のこと。これらの施設では、放射光を用いてナノテクノロジー・バイオテクノロジー・産業利用まで幅広い研究が行われている。
[2]脂質キュービック相法:
膜タンパク質を脂質二重層に再構成させた状態で結晶化させる方法。近年、本手法により結晶化が実現した膜タンパク質の結晶構造決定の例が多く報告されている。
[3]ホモ二量体:
二量体は、2つの分子が物理的・化学的な作用によって集合した状態。同一分子の二量体をホモ二量体、異種分子による二量体をヘテロ二量体という。本研究におけるDcytbの立体構造は、ホモ二量体である。
[4]ヘム:
ポルフィリンと呼ばれる環状平面分子の中心に鉄原子をもつ化合物。ポルフィリン環の修飾の種類や位置によっていくつかの種類に分類される。ヘムを分子中に取り込んで、はじめてその機能が発揮されるタンパク質をヘムタンパク質と呼び、通常、赤色を呈する。酸素運搬体であるヘモグロビン、電子伝達に関与するシトクロム類、酵素活性をもつペルオキシダーゼなどがヘムタンパク質の代表例。本研究対象のDcytbもヘムタンパク質であり、ヘムを介して細胞質側から腸管腔側へ電子を伝達する。
[5]ビタミンC:
L-アスコルビン酸のこと。水溶性ビタミンの一種で、生体内では還元剤として機能する。ヒトは体内でビタミンCを生合成できないため、食餌などにより外部から摂取する必要がある。
研究グループ
兵庫県立大学大学院 生命理学研究科 細胞制御学Ⅱ研究室
教授 城 宜嗣(しろ よしつぐ)
助教 澤井 仁美(さわい ひとみ)
博士課程リーディングプログラム大学院生 Menega Ganasen(メネガ ガナセン)
大学院生 武田 英恵(たけだ はなえ)
学部生 [研究当時] 朝倉 帆南(あさくら ほなみ)
理化学研究所 放射光科学研究センター 利用システム開発研究部門 生物系ビームライン基盤グループ 生命系放射光利用システム開発チーム
専任研究員 杉本 宏(すぎもと ひろし)
専任研究員 當舍 武彦(とうしゃ たけひこ)
専任技師 平田 邦生(ひらた くにお)
基礎科学特別研究員 [研究当時] 山下 恵太郎(やました けいたろう)
理化学研究所 放射光科学総合研究センター 城生体金属科学研究室 [研究当時]
特別研究員 [研究当時] 冨樫 ひろ美(とがし ひろみ)
島根大学 医学部 生化学講座 病態生化学
教授 浦野 健(うらの たけし)
技術専門職員 成相 裕子(なりあい ゆうこ)
メリーランド大学 カレッジパーク校 動物鳥類科学部
教授 Iqbal Hamza(イクバル ハムザ)
特任助教 Xiaojing Yuan(シャオジン ユエン)
ブリティッシュコロンビア大学 生化学分子科学生物学部 血液研究センター
教授 A. Grant Mauk(グラント マウク)
研究サポート
本研究は、文部科学省科学研究費補助金の基盤研究(B) (課題番号18H02396)、基盤研究 (C) (課題番号18K05321)の一環として行われました。さらに、公益信託山村富美記念女性自然科学者研究助成基金、公益財団法人ひょうご科学技術協会、理化学研究所の新領域開拓課題「分子システム研究」ならびに独創的研究課題「脂質の統合的理解」と「物質階層の原理を探求する統合的実験研究」による支援を受けて進められました。
【問い合わせ先】 杉本 宏(すぎもと ひろし) 機関窓口 理化学研究所・広報室・報道担当 (SPring-8 / SACLAに関すること) |
- 現在の記事
- 貧血予防に新たな指針 ~ ビタミンCが鉄分の吸収を促進するメカニズムを原子レベルで解明 ~(プレスリリース)
 sci.u-hyogo.ac.jp
sci.u-hyogo.ac.jp