細胞内の亜鉛の新しい生理的役割が明らかに ―亜鉛とシャペロンタンパク質ERp44による新しいタンパク質品質管理機構の仕組みを解明―(プレスリリース)
- 公開日
- 2019年02月13日
- BL44XU(生体超分子複合体構造解析)
2019年2月13日
東北大学 多元物質科学研究所
発表のポイント
• 細胞中のタンパク質の品質管理において、亜鉛が必須の役割を果たしていることを世界で初めて明らかにしました。
• 亜鉛は、分泌タンパク質の品質を監視するシャペロンタンパク質ERp44に一時的に結合してERp44の大きな構造変化を誘導し、結合相手となるタンパク質との相互作用を促進することを原子レベルで明らかにしました。
• 細胞内でのERp44の正常な機能には、亜鉛イオンが細胞のゴルジ体に局在する亜鉛トランスポーターによって、ゴルジ体中に取り込まれることが必要であることが分かりました。
東北大学多元物質科学研究所の渡部聡助教、天貝佑太助教、稲葉謙次教授(生命科学研究科、大学院理学研究科化学専攻 兼任)、およびサン・ラファエル研究所(イタリア)のシティア教授らの共同研究グループは、JST戦略的創造研究推進事業において、あらゆる生物の生育に必須な金属イオンである亜鉛イオンが、細胞内での正常なタンパク質の品質管理に関わるという亜鉛の新しい生理的役割と分子機構を初めて明らかにしました。細胞内では、ERp44と呼ばれるシャペロンタンパク質注1)が、細胞内で作られるタンパク質の品質を監視する役割を果たしますが、ERp44とその対象となる様々な未成熟タンパク質との相互作用が、亜鉛イオンによって促進されることが分かりました。また細胞内でのERp44の正常な細胞内局在と機能には、細胞のゴルジ体に局在する亜鉛トランスポーター注2)によって亜鉛がゴルジ体に取り込まれることが必要であることが分かりました。さらに亜鉛イオンが結合したERp44の立体構造を 大型放射光施設SPring-8のBL44XUおよび大学共同利用機関法人 高エネルギー加速器研究機構 物質構造科学研究所 フォトンファクトリーのBL1Aを用いたX線結晶構造解析注3)によって決定し、亜鉛によるERp44の構造機能制御の仕組みを原子レベルで明らかにしました。 【論文情報】 |
研究の背景
亜鉛は、あらゆる生物にとって必要な金属イオンであり、様々なタンパク質の立体構造を安定させる役割や、酵素タンパク質の活性中心に配位し、種々の化学反応を触媒する役割があります。また哺乳動物細胞内では、亜鉛は細胞内のシグナル伝達分子として機能していることも知られており、亜鉛のさらなる生理的役割に注目が集まっています。亜鉛は、細胞膜上に存在するZIPファミリーの亜鉛トランスポーターによって細胞内に取り込まれ、さらにZnTファミリーの亜鉛トランスポーターによって、ゴルジ体などの細胞の分泌経路中に取り込まれます。しかし、分泌経路に取り込まれた亜鉛の生理的な役割については、不明な点が多く残されていました。
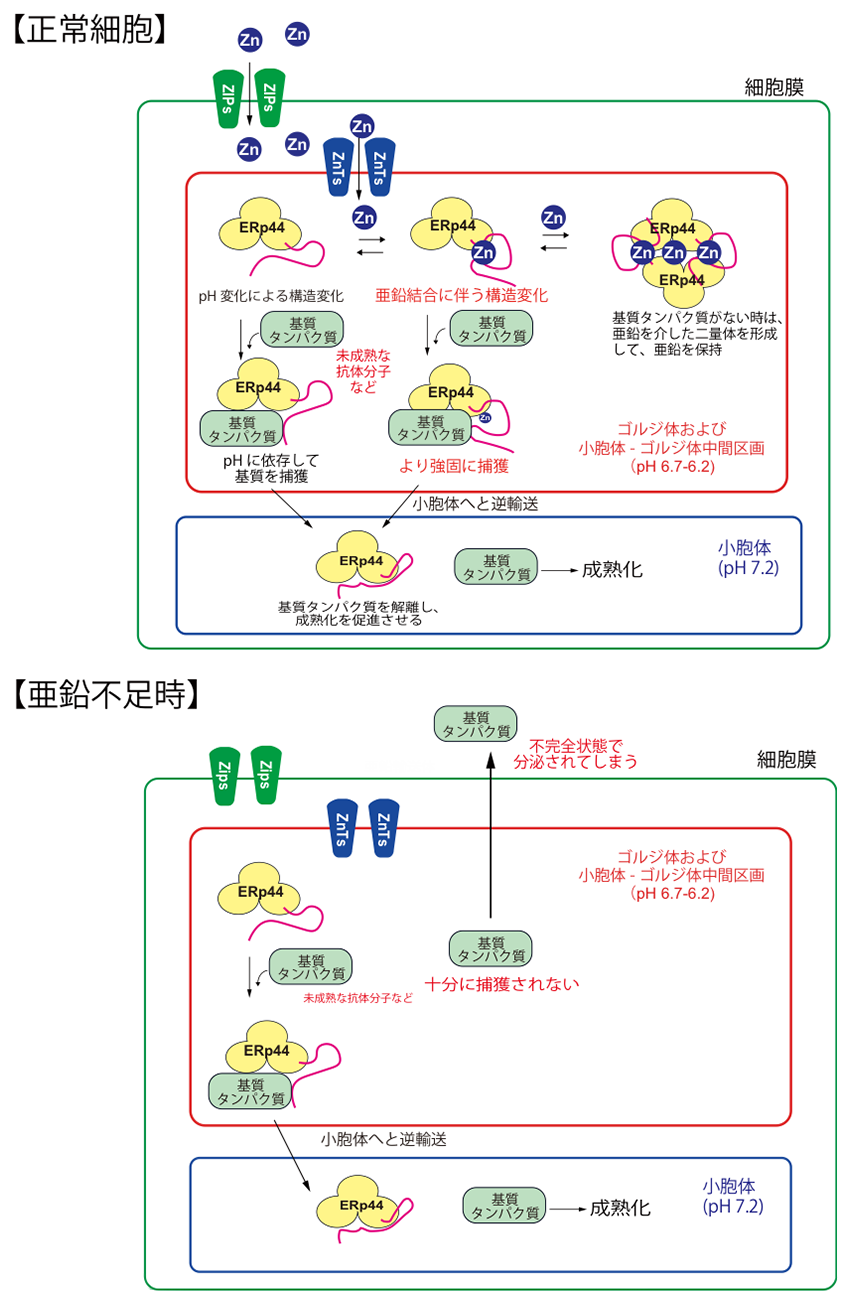
一方、細胞の分泌経路では、合成されたタンパク質の正常な品質を管理する仕組みが備わっています(タンパク質の品質管理)。この品質管理機構において、ERp44というシャペロンタンパク質は、高次構造上未成熟な抗体分子などの分泌タンパク質(基質タンパク質)をゴルジ体で捕獲し、小胞体へと戻し、成熟化を促進させる役割を担います(図1)。一部の小胞体局在タンパク質もERp44によってゴルジ体から小胞体へと逆輸送されます。これまでの我々の研究によって、ERp44は、小胞体とゴルジ体の間のpH変化を利用して、様々な基質タンパク質を認識するメカニズムを明らかにしてきました。またERp44には、Hisクラスターと呼ばれる、アミノ酸の一つヒスチジン注5)が集中した領域があることが分かり、ここに金属イオンが結合することが予想されました。しかし、その作用メカニズムは分かっていませんでした。
研究の成果
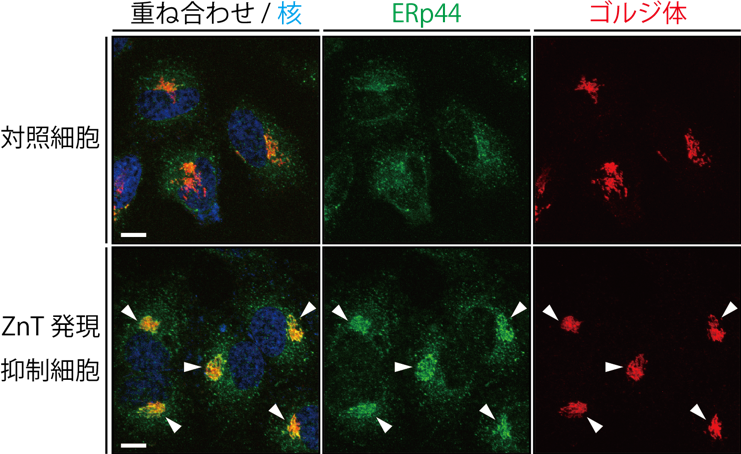
本研究では、まずERp44と種々の金属イオンと相互作用を調べた結果、亜鉛と特異的にサブマイクロモーラーの親和性で結合することが、等温滴定カロリメトリーなどの方法によって分かりました。そこで、細胞中でのERp44の動態と亜鉛との関係を調べるため、亜鉛キレート剤注6)によって細胞中の亜鉛を枯渇させたところ、ERp44がゴルジ体へと蓄積する様子が観察されました。またゴルジ体に存在するZnTファミリーの細胞内発現を遺伝子ノックダウン注7)により抑制したところ、亜鉛を枯渇させた状態と同じように、 ERp44がゴルジ体に蓄積する様子が観察されました(図2)。また亜鉛トランスポーターの発現抑制によって、ERp44の基質タンパク質輸送活性能が著しく阻害されることが明らかになりました。つまり、ERp44が細胞中で正常に機能するためには、ZnTファミリーによって亜鉛がゴルジ体中に取り込まれることが必要であることが分かりました(図1)。
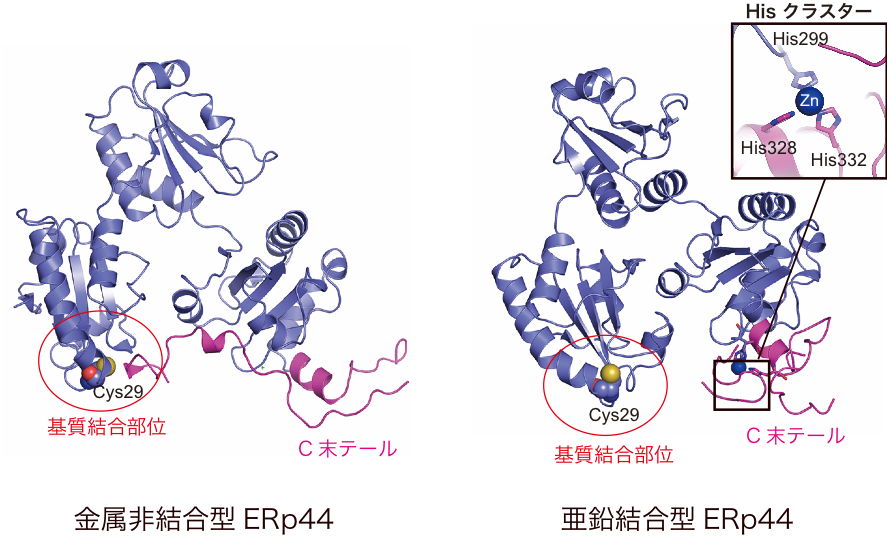
さらに亜鉛とERp44との結合様式を明らかにするために、亜鉛結合型ERp44の立体構造をSPring-8のBL44XUおよびフォトンファクトリーのBL1Aを用いたX線結晶構造解析により2.45 Å分解能で決定しました(図3)。構造解析の結果、予想どおり、亜鉛はERp44中の保存されたHis クラスターに結合することが明らかになりました。亜鉛が結合しない状態では、ERp44の基質結合部位は、C末テール領域に覆われていますが(図3左)、興味深いことに、亜鉛がHisクラスターに結合することに伴ってC末テールが大きく開き、基質結合部位が完全に露出することが明らかになりました(図3右)。その結果、亜鉛結合型ERp44では、基質タンパク質に対する親和性が著しく上昇することが分かりました。一方、基質がない状態では、亜鉛がHisクラスターとは異なる別の部位にも結合することで、ERp44が二量体を形成することも分かりました。以上の結果から、細胞内の亜鉛濃度によってERp44と基質タンパク質との結合解離が制御されるという全く新しいタンパク質品質管理機構のモデルを提唱しました(図1)。
今後の展望
今回の発見によって、必須金属である亜鉛の新しい生理的機能が明らかになり、亜鉛不足によって細胞のタンパク質品質管理に障害が生じることが分かりました(図1下)。亜鉛が不足すると、味覚障害をはじめとして、免疫力低下、皮膚炎、成長の遅れなど様々な症状が引き起こされることが知られていますが、発症メカニズムについては不明な点が多く残されています。今回の成果は、これら疾病の発症メカニズム解明に向けた基盤の一つになることが期待されます。
【用語説明】
注1)シャペロンタンパク質:
他のタンパク質の立体構造形成を補助するタンパク質群の総称で、折れ畳み途中のタンパク質の凝集を防いだり、細胞内の適切な区画への運搬を手伝う。
注2)亜鉛トランスポーター:
生体膜を貫通し、膜を横切って亜鉛イオンの輸送を行う膜内在性のタンパク質。
注3)X線結晶構造解析:
分子の構造を高分解能で決定する手法の一つ。分子が規則正しく並んだ結晶に強いX線を照射すると回折という現象が起こり、回折データを解析することで、結晶を構成する分子の構造を原子レベルで決定することができる。
注4)亜鉛欠乏症:
人体にとって必須微量元素である亜鉛が欠乏することによって生じる疾患で、典型的な症状として、味覚障害、貧血、皮膚炎、脱毛症、発育障害、不妊症などがある。
注5)ヒスチジン:
アミノ酸の一つであり、塩基性のイミダゾール基を含む化学構造をもつ。金属イオンとの結合や周りのアミノ酸との水素結合などに関与し、多くのタンパク質の機能発現や高次構造の維持に寄与する。
注6)キレート剤:
分子内に複数の配位子を含み、金属イオンと強固に結合し、金属錯体を形成する薬品の総称。
注7)遺伝子ノックダウン:
20~25塩基程度の長さの微小RNAなどを用いて、細胞中の特定の遺伝子の転写量(タンパク質レベルでは発現量)を大きく減少させる操作。
図1 亜鉛とpH によるタンパク質品質管理の仕組み
亜鉛は、ZIPファミリーによって細胞内に取り込まれ、さらにZnTファミリーによって分泌経路中のゴルジ体に取り込まれる。ERp44は小胞体とゴルジ体間のpH変化を利用して、未成熟な抗体などのタンパク質ゴルジ体で捉え、小胞体に逆輸送することを過去に報告した。今回の成果によって、ERp44は亜鉛イオンと結合することによって、基質タンパク質をより強固に捉え、さらに高効率で逆輸送することを明らかにした(上図)。しかしながら、亜鉛不足状態になると、ERp44は、未成熟タンパク質を十分に捕獲できなくなり、基質タンパク質が不完全な状態で過剰に分泌されてしまう様子も観察された(下図)。
図2 ZnT発現抑制細胞のERp44免疫染色
ヒト子宮頸がん由来HeLa細胞中のERp44(緑)、ゴルジ体(赤)、核(青)を染色し、共焦点レーザー顕微鏡で観察した。定常状態では、ERp44は小胞体、小胞体ーゴルジ体中間区画、一部のゴルジ体に局在し、細胞中に広がって局在する(上段)。ゴルジ体に局在する亜鉛トランスポーター(ZnT)を発現抑制すると、ERp44がゴルジ体に蓄積する(下段中の矢頭)。このことから、ERp44はゴルジ体でZnTを介して亜鉛イオンを獲得し、小胞体へ局在を変化させることが明らかとなった。
図3 亜鉛結合型ERp44の立体構造
X線結晶構造解析の結果、亜鉛は、ERp44の保存されたHisクラスター(His299, His328, His332)に結合することが分かった(図3右上、挿入図)。その結果、亜鉛非結合状態ではクライアント結合部位を覆っているC末テール(赤紫色表示)が(図3右)、亜鉛結合に伴って大きく開き、基質結合部位が大きく露出する様子が示された。
お問い合わせ先: (報道に関すること) (SPring-8 / SACLAに関すること) |
- 現在の記事
- 細胞内の亜鉛の新しい生理的役割が明らかに ―亜鉛とシャペロンタンパク質ERp44による新しいタンパク質品質管理機構の仕組みを解明―(プレスリリース)
 tagen.tohoku.ac.jp
tagen.tohoku.ac.jp