大腸菌に緑色蛍光タンパク質(GFP)をつくらせると、 わずかな違いをもつ2種類のGFPができることを発見(プレスリリース)
- 公開日
- 2019年03月18日
- BL41XU(構造生物学I)
2019年3月18日
岡山大学
発表のポイント
・緑色蛍光タンパク質(GFP)は、遺伝子を導入することでさまざまな細胞につくらせることができ、生体分子の観察や分析の手段として生命科学研究に幅広く用いられています。
・大腸菌でGFPを作らせると、性質と化学構造がわずかに異なる2種類のGFPができることを発見しました。
・GFPを用いる生命科学研究において、重要な基盤情報となります。
岡山大学大学院医歯薬学総合研究科(薬)の中谷隆寛さん(17年まで大学院生)、安井典久准教授、山下敦子教授と薬学部の田村一晟さん(薬学科5年生)のグループは、緑色蛍光タンパク質 (Green Fluorescent Protein, GFP) を大腸菌につくらせると、性質がわずかに異なる2種類のGFPができ、両者の違いは、質量がわずか1グラムの6兆分の1のさらに1000億分の1 (1.66 × 10-27 kg, 1 Da) だけ異なるGFPの化学構造にあることを明らかにしました。 【論文情報】 |
<現状>
GFPは、2008年のノーベル化学賞を受賞した故下村脩博士が、1962年にオワンクラゲから発見した蛍光タンパク質で、クラゲの発光器官が光を発するしくみを担うタンパク質です。1994年には、下村博士と同時受賞したマーティン・チャルフィー博士が、大腸菌も含めたさまざまな生物にGFPの遺伝子を導入すると、それらの生体内でGFPがつくられ、蛍光を発することを発見しました。以来、研究対象のタンパク質とGFPを融合させ、さまざまな細胞でつくらせることで、対象タンパク質の細胞の中での居場所を蛍光で観察したり、対象タンパク質の性質を蛍光で検出して分析するなど、GFPは生命科学研究に幅広く利用されています。
通常、細胞に遺伝子を導入すると、DNAに保存されている遺伝情報がmRNAに転写され、さらにタンパク質に翻訳される、という順序でタンパク質がつくられます(このことは「セントラルドグマ」と呼ばれています)。さらに、タンパク質が作られてから、何らかの反応が起こって、タンパク質の化学構造が変化することがあり、このような現象は「翻訳後修飾」と呼ばれています。GFPは、四半世紀に渡り、さまざまな研究対象タンパク質の「蛍光ラベル」として生命科学研究に利用されてきましたが、そのGFP自体に変化があるかどうかについては、あまり調べられていませんでした。
<研究成果の内容>
研究グループは、大腸菌にGFPuvという翻訳されやすいGFP遺伝子を導入してタンパク質をつくらせ、できたGFPを分子の大きさの違いで分離できる電気泳動法で分析すると、泳動度が異なる2種類の分子種ができていることを発見しました。それらのGFP分子種を、分子の表面荷電の違いで分離できる陰イオン交換クロマトグラフィー法で単離し分析すると、表面荷電の指標となる等電点の値が、1種は5.76、もう1種は5.64と、わずかに異なっていることがわかりました。
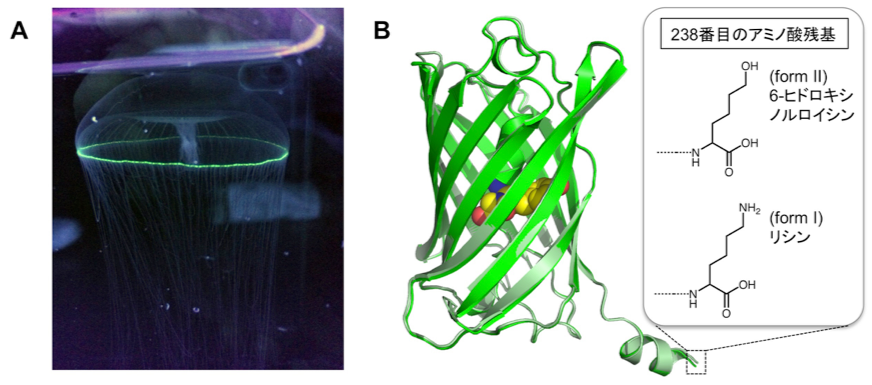
このような違いが生まれる原因の一つとしてよく見られるのが、つくられたタンパク質の一部が酵素で分解され切れているケースです。そこで、そのようなことが起こっているかどうか、タンパク質の質量を精密に調べる質量分析を行いました。すると、2種類のGFPの質量の違いはわずか1 Da、つまり1グラムの6兆分の1のさらに1000億分の1 (1.66 × 10-27 kg) しかないことがわかりました。このわずかな違いは、もっと大きな質量変化が予想されるタンパク質分解では説明できません。そこでさらに分析したところ、これら2種類のGFPは、タンパク質の最後に位置する238番目のアミノ酸残基が、遺伝情報どおりのリシンのものと、通常タンパク質を構成するアミノ酸には含まれない6-ヒドロキシノルロイシンのものであることが明らかになりました。つまり、前者はセントラルドグマどおりのもので、後者はそこからさらに翻訳後修飾が起こったものと考えられます。
2種類のGFPは、他の性質には目立った違いは見られませんでした。例えば、GFP全体の立体構造や、蛍光を発する発色団付近の構造には違いがないことを、大型放射光施設SPring-8のBL41XUを用いたX線結晶構造解析で確認しました。両者の蛍光特性にもほとんど違いはありませんでした。
なお、クラゲの発光器官内にあるGFPを調べたところ、ほとんどが遺伝情報通りのリシンを持つものでした。このことから、上述した翻訳後修飾は、GFPを大腸菌でつくらせたことによって生じたものと考えられます。
<社会的な意義>
GFPを細胞でつくらせる実験は、さまざまな生命科学研究で行われています。これまでGFPそのものの翻訳後修飾の報告はありませんでしたが、本研究により、細胞に遺伝子を導入してGFPをつくらせた場合、条件によっては、今回見つかったような翻訳後修飾が起こりうることがわかりました。このことは、GFPを研究の道具として利用するときに、GFP自体が変化している可能性を考慮に入れる必要があることを示しています。本研究成果は、GFPを用いる生命科学研究における重要な基盤情報となります。
図. (A) オワンクラゲ。緑色に光っているところが発光器官。(写真は京都水族館提供)
(B) 2種類のGFPの立体構造。238番目のアミノ酸残基としてリシンを持つもの(form I, 緑色)と6-ヒドロキシノルロイシンを持つもの(form II, 薄緑色)の2つの構造を重ね合わせて表示している。中央にある黄色の部分は蛍光を発する発色団である。
■研究資金
本研究は、日本学術振興会・科学研究費補助金(17H03644、25891017、 15H05370)の支援を受けて実施しました。
◆研究者からのひとこと
 この論文は、研究室第1期生で、とびきり実験が上手かった中谷さんが、わずかに違う2種類のGFPを見事に分離して解析、両者の違いを明らかにし、現所属生でやはり実験が上手い田村さんが、重要な詰めの実験であるGFPの蛍光分析を行ってまとまった研究成果です。(山下)
この論文は、研究室第1期生で、とびきり実験が上手かった中谷さんが、わずかに違う2種類のGFPを見事に分離して解析、両者の違いを明らかにし、現所属生でやはり実験が上手い田村さんが、重要な詰めの実験であるGFPの蛍光分析を行ってまとまった研究成果です。(山下)
<お問い合わせ> (SPring-8 / SACLAに関すること) |
- 現在の記事
- 大腸菌に緑色蛍光タンパク質(GFP)をつくらせると、 わずかな違いをもつ2種類のGFPができることを発見(プレスリリース)
 okayama-u.ac.jp(安井)
okayama-u.ac.jp(安井)