加熱しても壊れない、食中毒原因菌・ 腸炎ビブリオの毒素に迫れ!!
60年前の大規模食中毒事件
1950年10月、大阪南部で、患者272名、死者20名を出す、戦後最大の食中毒事件がありました。患者がシラス干しを食べてから約1時間後に腹痛を訴え、嘔吐・下痢をしたことから、大阪大学微生物病研究所(阪大微研)の故・藤野恒三郎名誉教授は、シラス干しに繁殖していた腸炎ビブリオが原因菌だと突き止めました。以来、腸炎ビブリオは日本ではじめて発見された食中毒原因菌として、藤野先生の弟子から弟子へと、その研究が受け継がれてきました。
ひ孫弟子にあたる柳原格(いたる)先生は、阪大微研から大阪府立母子保健総合医療センターに移った今も、腸炎ビブリオの研究を続けています。2010年5月には、腸炎ビブリオがつくるタンパク質毒素(耐熱性溶血毒;略称TDH)の立体構造を、原子のレベルの細かさで解明することに成功しました。この成果は、阪大微研の本田武司名誉教授と横浜市立大学の橋本博助教らとの共同研究によるものです。
食中毒発生のメカニズムの解明につながる成果として注目されています。
巧みに悪さをする腸炎ビブリオ
腸炎ビブリオは、発見者の藤野先生が「丸くて太っちょ」と表現したように、長さ約2マイクロメートル(μm:1μmは100万分の1m)のずんぐりとした俵形で、1本の太いべん毛と細かいべん毛をもつ細菌です(表紙写真)。べん毛をモーターのように使って海を泳ぎ回り、魚介類に付着します。このときは、食中毒を起こすほどの菌の数ではありません。ところが、腸炎ビブリオにとって最適とされる温度と塩分がある環境では、10分に1回の速さで分裂して増えるのです。このスピードで増殖すると、1個の菌が1時間では64個に、6時間後には687億個になるのですから、ものすごい増殖力です。こうして、食中毒を起こします。
腸炎ビブリオは人間の体の中に入り腸管に付着すると、自らのタンパク質を送り込むための分泌装置を、船のイカリのようにおろして、ほかの細菌を腸内から排除し強く定着します。さらに恐ろしいことに、宿主の心臓の筋肉細胞などを破壊する毒素を分泌します。この毒素は熱に強いことと、発見当初に、赤血球の細胞膜に孔を開け破裂させる性質があるとわかったので、耐熱性溶血毒と呼ばれています(写真1)。

写真1.TDHが細胞膜に開ける孔(左)と溶血の様子(右)
血液の入った寒天にTDHを入れると、溶血がおこり透明に抜ける。
(左写真の出典:日本細菌学会 細菌学教育用映像素材集(第2版)三輪谷俊夫、本田武司)
加熱しても消えない毒性?!
「少しくらい日にちがたっても、十分加熱すれば食べても大丈夫などといいますが、腸炎ビブリオの場合そういうわけにはいきません」と柳原先生。タンパク質は一般的に、熱によって変性すると元に戻りません。身近な例としては、ゆで卵が生卵に戻らないことがあげられます。だから、加熱すれば大丈夫といわれるのです。しかし腸炎ビブリオの場合、加熱によって菌は死滅しても、毒素であるTDHはその後の温度変化によっては、いったん失った毒性を回復させることがあるのです。このような現象は、発見者の名前を取ってアレニウス効果と呼ばれています。腸炎ビブリオがつくるTDHにアレニウス効果があることは、1972年に阪大微研の故・三輪谷俊夫名誉教授が発見しました。しかし、くわしいメカニズムの解明にまではいたりませんでした。
TDHの毒性は構造で決まる
柳原先生が、TDHのアレニウス効果に注目するようになったのは、TDHとβグロブリン(牛乳に含まれるごく一般的なタンパク質)が結合することを発見したからでした。βグロブリンを実験装置の膜に固定して実験するとTDHが結合するのに、TDHを膜に固定するとβグロブリンは結合しませんでした。その理由を柳原先生は、膜に固定されたことで、TDHの立体構造が壊れたからではないかと考えました。つまり、構造がTDHの性質を決めているのです。
そこで、さまざまな測定装置を使って、温度による構造変化を追いながら、毒性を評価しました(図1)。その結果、TDHは毒性をもつ構造(TDHn)のほかに、温度によって線維状*1(TDHi)や、ほどけたような構造(TDHu)をとることがわかりました。このとき仲間とともに、「TDHのアレニウス効果は構造で説明できる」と大喜びしたといいます。
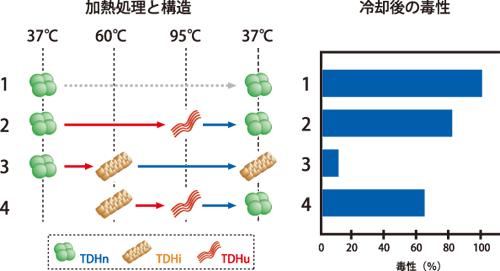
図1.腸炎ビブリオの毒素TDHのアレニウス効果
もとの毒性(TDHn;1)を100%として、加熱処理した後に残る毒性とTDHの構造変化を示す。60°Cで加熱処理したとき(3)だけ、線維状(TDHi)になり、その後冷ましても毒性は消える。60°Cより高い温度にすると、ほどけた状態の構造(TDHu)をとって毒性を失うが、体温の温度に戻すと巻き戻りによってTDHnになり、毒性が回復する(2,4)。
本当に4量体なのか?
TDHの構造に関する実験をしていると、毒性をもつTDHが4量体*2を形成しているらしいとわかってきました。しかし、2量体と考えられてきた毒素が、4量体だと証明するには原子レベルの解析がどうしても必要でした。そこで、構造を直接見ようということになり、横浜市大の橋本先生の協力を得て、TDHを結晶化してX線結晶構造解析を行ったのです(図2)。使用したのは、SPring-8のビームラインBL41XU、BL40B2と高エネルギー加速器研究機構のビームラインです。10年ほど前にもTDHの構造解析にチャレンジしたことがありましたが、うまくいきませんでした。「解析できる大きさの良質な結晶をつくるのは、簡単ではありません。しかし、以前もある程度の結晶はできていました。SPring-8の放射光実験技術は年々向上しています。これまで見えなかったものが、次々に見えるようになっているのです」と橋本先生。今回の成功の鍵は、測定技術の進歩にあったと話します。
TDHの立体構造がわかったことで、研究は大きく前進しました。TDHの4量体構造の中心部分には直径約2ナノメートル(nm:1nmは10億分の1m)、深さ約5ナノメートルの孔が認められました。スーパーコンピューターを使った分子シミュレーションでは、この孔を水分子が高速で通過することがわかり、この孔が細胞膜に孔を開けると考えられます。
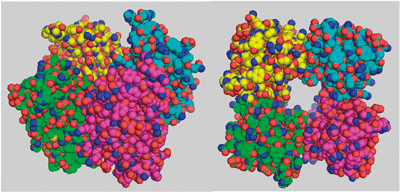
図2.毒素TDHの結晶構造
4量体構造の様子(左):色分けされた4本の鎖が集合している。上から見た図(右):中央に貫通した孔が開いているのがわかる。球1つ1つは原子を表している。
TDH研究の最後の詰め
「あとは、TDHがどのように細胞膜に近づき孔を開けて毒性を発揮するのかを明らかにするばかりです」と柳原先生は研究の集大成に入ろうとしています。先生の頭の中には、すでにそのモデルができています。しかし、証明できなければ単なるモデルに過ぎないと、厳しく考えています。そして、「モデルが正しいかどうかを明らかにするには、対象を結晶化しなくても構造観察ができるほど強い放射光があればいいんです」とSPring-8の進歩とまもなく稼働するX線自由電子レーザー(XFEL)に期待しています。
60年にわたる研究によって、食品管理の大切さが理解され、腸炎ビブリオの検査法も確立し、患者数はかなり減ってきました。そして今も、発見者である藤野先生の「腸炎ビブリオ感染症例をゼロに」という願いを実現させたいと、後進たちが研究を続けているのです。
用語解説
*1 線維状
分子がいくつも連なった棒のような細長い構造。
*2 4量体
タンパク質は多数のアミノ酸が鎖のように連なった高分子化合物である。複数の鎖が集まって接触し、1つのまとまった働きをもつものを多量体という。1本の場合は単量体、2本では2量体、4本では4量体となる。また、それぞれの鎖をサブユニットという。
コラム:いい仲間に囲まれて
 |
| 共同研究者の橋本先生(左)とともに |
「阪大微研で何十年も研究されているのに解けなかった問題にアプローチするには、理学や工学の力が必要でした」と柳原先生が話すように、今回の研究にはさまざまな分野の研究者がかかわっています。皆、阪大微研時代に、隣近所の研究室にいた30代半ばの若手研究者でした。橋本先生も仲間の1人でした。ああでもないこうでもないと議論しあったこと。夜中なら誰も使わないからと、工学部の装置を好きなだけ使わせてもらったこと。すべてが楽しい思い出でした。
そして、研究の場が大阪府立母子保健総合医療センターに移ってからも、小児科医をやりながら腸炎ビブリオの研究を続けられるのは、周囲の理解があるからだと感謝しています。
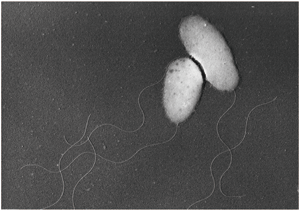 |
表紙の図
食中毒原因菌、腸炎ビブリオの電子顕微鏡写真。この写真では菌体と太いべん毛が見られる。 |
取材・文:サイテック・コミュニケーションズ 池田亜希子
この記事は、大阪府立母子保健総合医療センター 研究所免疫部門の柳原格部長と横浜市立大学 生命ナノシステム科学研究科の橋本博助教にインタビューをして構成しました。