放射光軟X線を用いて選択的DNA損傷の誘発に成功-新たなDNA操作技術への応用につながると期待-(プレスリリース)
- 公開日
- 2009年11月05日
- BL23SU(JAEA 重元素科学)
平成21年11月5日
独立行政法人日本原子力研究開発機構
|
独立行政法人日本原子力研究開発機構(理事長 岡﨑俊雄、以下「原子力機構」という。)先端基礎研究センター放射線作用基礎過程研究グループの藤井健太郎研究員らは、大型放射光施設SPring-8の軟X線※1を用いて選択的にDNA損傷※2を誘発させることに世界で初めて成功しました。これにより、将来、DNAの修復に関する医療等の研究分野やDNAをナノデバイスとして利用する産業開発等の分野において、新たなDNA操作技術への応用が期待されます。 原子力機構はこれまで、放射線による細胞の致死や突然変異などの主要な原因とされるDNA損傷がどのように誘発されるかを、SPring-8から得られる軟X線を利用して調べる研究を行ってきました。分光器と呼ばれる装置を用いると、軟X線のエネルギーを選択することが出来、一般的な放射線では困難であったDNA中の特定元素に対する高効率のイオン化※3が可能となります。そこで、軟X線のエネルギーを選ぶことでDNA中の炭素、窒素及び酸素をそれぞれ選択的にイオン化し、この時に生成する様々なDNA損傷の誘発頻度を調べてきました。その結果、鎖切断※4タイプ(DNAの鎖が切断するタイプの損傷)とプリン塩基変異タイプ及びピリミジン塩基変異タイプ(ともに遺伝情報を担う核酸塩基※5の変異)の3種類のDNA損傷を、元素を選択的にイオン化させることにより、異なる効率で誘発させることに成功しました。 (論文) |
1. 背景
原子力機構は大型放射光施設SPring-8において、様々な物性及び生命科学研究のための軟X線ビームラインである、JAEA重元素科学ビームラインBL23SUを開発・整備してきました(図1)。今回の研究成果は、このビームラインに設置されている生体試料の照射・測定研究のための専用装置を用いて行われたものです。放射線が生体に対して細胞致死や突然変異・発ガンを誘発することは良く知られていますが、その主要な原因のひとつがゲノムのDNA分子上に生じる化学変化(DNA損傷)であることが従来から指摘されています。そこで、もし放射線により特定の損傷を選択的にDNA分子中に誘発させることができれば、この分野の研究が大きく進展すると期待されています。一般に用いられる放射線はイオン化作用が大きく、様々なDNA損傷(図2)が同時に誘発されるため、損傷と生物学的な影響の因果関係の詳細な解析は困難とされていました。
2. 研究内容
本研究では、軟X線のエネルギーを選ぶことでDNA中の炭素、窒素及び酸素をそれぞれ選択的にイオン化し、この時に誘発される鎖切断タイプと塩基変異タイプの損傷のそれぞれの誘発頻度が変わるかどうかを探りました。DNA分子は主鎖骨格部位(糖とリン酸基)と遺伝情報を担う核酸塩基部位から構成されます。また、核酸塩基にはプリン塩基とピリミジン塩基が含まれます(図2)。DNAの二重らせんの両鎖が切断されると、細胞致死が高い頻度で起こるといわれています。一方、遺伝暗号を担う核酸塩基の損傷は、突然変異の主要な原因とされています。実験では、プラスミドと呼ばれる比較的構造が簡単なDNAの薄膜を作製しました。通常ではこのプラスミドDNA※6は、二重らせん構造がさらに捩れた「超らせん構造」をとります。このDNAの水溶液試料をガラスプレートの上に乗せて乾燥させ、厚み数マイクロメートルの薄膜試料を作製しました。この試料を真空チェンバー内に挿入し、分光器により炭素、窒素及び酸素のイオン化に必要なエネルギー※7に合わせた軟X線を照射しました(図1)。
軟X線照射によりプラスミドDNAの二重らせんの片鎖の切断(1本鎖切断)が1ヶ所でも生じると、超らせん構造が解けて開環状構造になります(図3(a))。このDNAの立体構造変化は、ゲル電気泳動法※8により比較的容易に検出・定量することができるため(図3(b))、DNAの鎖切断の誘発頻度を極めて高感度で調べることができます。
一方、核酸塩基の変異は、変異した塩基を鎖切断に変換する働きをもつ修復タンパク質※9との反応によって検出しました。(図4)。そこで、軟X線照射した時のDNA鎖切断と酵素反応によりさらに付加的に生じたDNA鎖切断との差から、核酸塩基の変異の誘発頻度を定量しました。本研究ではピリミジン塩基に生じた変異を鎖切断化するNthタンパク質とプリン塩基に生じた変異を鎖切断化するFpgタンパク質の2種類のタンパク質を用いました。
実験により得られた3種類のDNA損傷の誘発頻度を示した結果を、図5に示します。照射した軟X線のエネルギーの違いにより、損傷の誘発頻度が大きく変化することが確認されました。炭素のイオン化のみが起こる380 eVの照射では、主として1本鎖切断が生じます。一方、酸素をイオン化させた場合(560 eV照射)、核酸塩基変異の誘発頻度が約3倍にもなりました。さらに酸素イオン化エネルギーを大きく超えた760 eVを照射した場合では、プリン塩基変異が減少し、鎖切断タイプとピリミジン塩基変異タイプが主に誘発されます(図6)。
一般にプリン塩基は正孔を、ピリミジン塩基は電子を引き付けやすい性質を持ち、それらの正孔や電子と核酸塩基との相互作用により各損傷を引き起こすことが知られています。また、鎖切断タイプの損傷は鎖中の糖部位の分解により誘発されます。軟X線のエネルギーの違いにより元素が選択的にイオン化され、その結果生じる正孔や電子の挙動や糖の分解のしやすさがイオン化された元素の種類に依存するため、3種類のタイプの誘発頻度の違いが現れました。このような性質を利用して、イオン化する元素を変えることで主要なDNA損傷の種類を選択することができます。
一般的に用いられるX線(~200keV)やγ線(~MeV)などの高いエネルギーの放射線と比較すると、今回用いた軟X線のエネルギー同士の差は極めて小さく(~500eV)、僅かなエネルギーの違いがDNA損傷の種類の違いをもたらした例はこれまでありませんでした。今回の発見によりこれまでにない、新たなDNA操作技術への応用が期待されます。今後は軟X線吸収測定やラジカル観測など放射光を利用した様々な分光法を駆使して、DNA損傷の違いをもたらす物理的なメカニズムを解明していく予定です。
放射光実験は、大型放射光施設SPring-8の原子力機構専用ビームラインBL23SUの申請番号No. 2007A3822, 2007B3812, 2008A3813, 2008B3812の研究課題として行いました。本研究の一部は、科学研究費補助金「若手研究(B)」及び「基盤研究(B)」の採択課題として実施されました。
<参考資料>
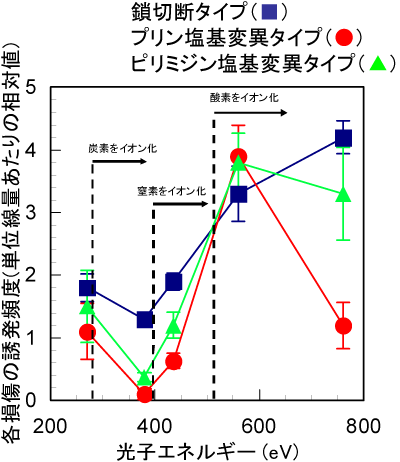 図5 各損傷の誘発頻度の光エネルギー依存性。
図5 各損傷の誘発頻度の光エネルギー依存性。(■:鎖切断タイプ、●:プリン塩基変異タイプ、▲:ピリミジン塩基変異タイプ。)
(図中炭素、窒素及び酸素をイオン化するエネルギーを破線で示した。各元素をイオン化することのできるエネルギー(矢印)で各元素の光吸収が起こる。)
<用語解説>
※1 軟X線
約0.1 - 2keVのエネルギーが低くて透過性の弱いX線。
※2 DNA損傷
DNAに起こる不可逆的な分子構造の変化で、大きく分けて、核酸塩基の変化、鎖の切断、架橋があげられる。
※3 イオン化
電荷的に中性な物質が、正または負の電荷をもつ原子あるいは原子団に変化する物理現象をイオン化、または電離と呼ぶ。イオン化に伴い分子外に電子が放出され、その結果、分子内に正孔(電子の不足によってできた孔で、見かけ上、正の電荷を持っているように見える)が生じる。
※4 鎖切断
DNA二重らせんの一本の鎖の糖―リン酸主鎖骨格部位の切断。糖部位の分解などの損傷によって生じる。
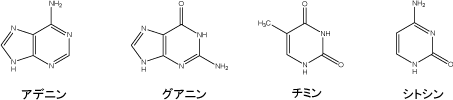
※5 核酸塩基
DNA中で遺伝情報を担う部分で、プリン塩基(アデニンとグアニン)とピリミジン塩基(チミンとシトシン)が含まれる。DNA二重らせんでは、アデニンはチミンと、グアニンはシトシンと水素結合による塩基対を形成する。
※6 プラスミドDNA
環状の二本鎖DNAで、細胞の染色体DNAとは別の分子である。大きさは、小さいもので数千塩基対、大きなものは数十万塩基対もある。元々のプラスミドDNAは捩れを伴った閉環構造を持つが、分子中に鎖の切断が1箇所存在すると、そのねじれが解け、開環構造に変化する。
※7 イオン化に必要なエネルギー
電子の内殻(K殻)への光子(X線)吸収が起こり、電離(イオン化)が起こるために必要なエネルギーは、炭素・280eV、窒素・400eV、酸素・535eV、リン・2150eVである。
※8 ゲル電気泳動法
DNAなどの電荷を持った物質が、その溶液に電場を加えたとき、一方の極に向かって移動する現象を利用して、ゲル内での移動距離の違いからDNAの形態や分子量を分離する実験手法。
※9 修復タンパク質
DNA損傷を除去する塩基除去修復では、DNA上の損傷を見つけて異常塩基のデオキシリボースとのN-グリコシド結合を加水分解するDNAグリコシラーゼと、その脱塩基部位を認識して、3’側あるいは5’側のホスホジエステル結合を切断するAPエンドヌクレアーゼという二種類のタンパクが存在することが知られている。塩基除去修復タンパク質の代表的なものとして、チミンやシトシンなどピリミジン塩基に生じた変異を認識・除去するエンドヌクレアーゼ III (Nth)とグアニンやアデニンなどプリン塩基に生じた変異を認識・除去するホルムアミドピリミジンDNAグリコシレース(Fpg)が知られている。
|
(問い合わせ先) (研究内容に関すること) (報道担当) (SPring-8に関すること) |
- 現在の記事
- 放射光軟X線を用いて選択的DNA損傷の誘発に成功-新たなDNA操作技術への応用につながると期待-(プレスリリース)
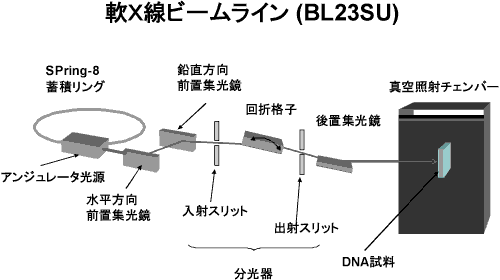 図1 軟X線ビームラインとそこに設置されたDNA試料照射用真空チェンバー
図1 軟X線ビームラインとそこに設置されたDNA試料照射用真空チェンバー
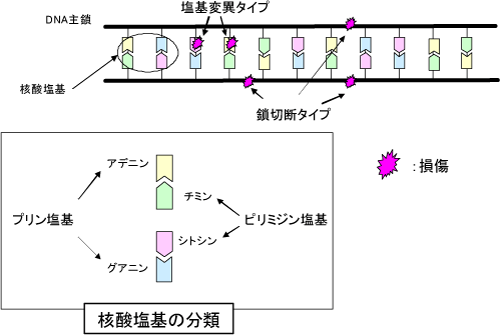 図2 様々なDNA損傷
図2 様々なDNA損傷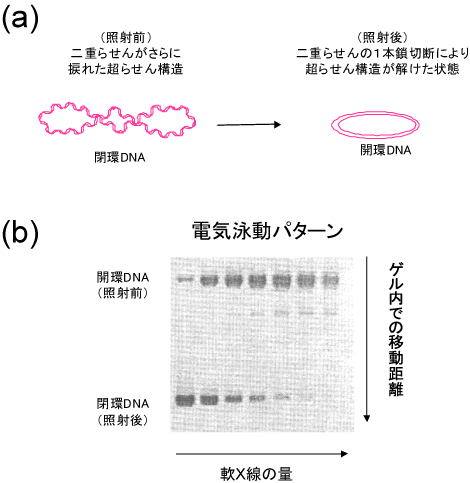 図3 ゲル電気泳動法によるプラスミドDNA鎖切断の検出
図3 ゲル電気泳動法によるプラスミドDNA鎖切断の検出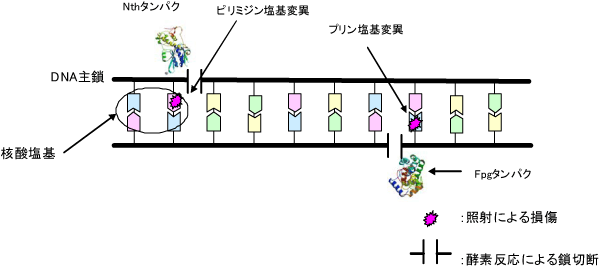 図4 FpgおよびNthタンパク質による核酸塩基変異の鎖切断化
図4 FpgおよびNthタンパク質による核酸塩基変異の鎖切断化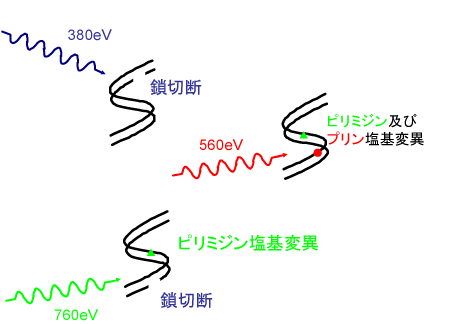 図6 選択的DNA損傷誘発の様子
図6 選択的DNA損傷誘発の様子