ニトリル合成を触媒するタンパク質の立体構造を解明-アルドキシム脱水酵素を活用した環境に優しいニトリル製造法の開拓に貢献-(トピック)
- 公開日
- 2009年11月09日
- BL41XU(構造生物学I)
- BL44B2(理研 物質科学)
2009年11月9日
大学共同利用機関法人自然科学研究機構
独立行政法人理化学研究所
富山県立大学
本研究のポイント
○ バイオ技術によるニトリル合成の確立に貢献
○ SPring-8の放射光を用いて活性型の酵素基質複合体を調製し、その構造解析に成功
○ アルドキシム化合物からニトリル化合物に変換されるメカニズムが明らかに
|
大学共同利用機関法人自然科学研究機構 (志村令郎機構長)、独立行政法人理化学研究所 (野依良治理事長)、富山県立大学 (田中正人学長) は、脱水反応によってニトリル化合物*1の合成を触媒する「アルドキシム脱水酵素 (Oxd)」*2の立体構造を世界で初めて解明しました。これは、自然科学研究機構岡崎統合バイオサイエンスセンターの青野重利教授、日本学術振興会の澤井仁美特別研究員、理研放射光科学総合研究センター城生体金属科学研究室の城宜嗣主任研究員、杉本宏専任研究員、そして富山県立大学工学部生物工学研究センターの浅野泰久教授、加藤康夫教授による共同研究の成果です。 (論文) |
1. 背景
ニトリル化合物は化学工業における重要な中間原料であり、溶剤・アクリル繊維の前駆物質・ナイロンの製造原料・ニトリル系除草剤原料など、その用途は極めて多岐にわたっています。このニトリル化合物を化学工業的に生産する際、前駆体であるアルドキシム化合物を厳しい条件下で反応させる方法が採られています。2000年に本研究グループは、幾種類かの土壌細菌がアルドキシム-ニトリル代謝経路を有し、その経路で機能する「アルドキシム脱水酵素 (aldoxime dehydratase, Oxd)」により、生物学的に温和な条件下でニトリルが合成されることを発見しました。その後も生化学および分子分光学的な研究を行い、Oxdがヘム*5を補因子として活性中心に含むヘム酵素であることが明らかになりました。これまでに、脱水反応を生理機能とするヘム酵素はOxd以外に報告例はありませんでした。また青野教授らは、Oxdは既知のヘム酵素とは異なり、ヘム鉄の酸化状態の変化によって触媒反応が制御されることも突き止めました。すなわちOxdの基質アルドキシムは ”還元型ヘム鉄 (Fe2+) を含む活性型酵素” にも “酸化型ヘム鉄 (Fe3+) を含む不活性型酵素” にも結合して酵素基質複合体を形成するにも関わらず、基質が還元型ヘム鉄に結合した場合のみ反応が進行します (図1)。このような珍しい性質を持つOxdですが、分子構造は明らかになっておらず、具体的な反応メカニズムも謎のままでした。
2. 研究手法と成果
本研究グループは土壌細菌Rhodococcus sp. N-771株からクローニングしたOxd遺伝子を大腸菌体内に組込み、Oxdを生産する遺伝子組換え大腸菌を構築し、これを用いてOxdを大量に調製しました。不純物をほとんど含まない状態までOxdを精製した後、単結晶化に成功しました。その際、酸化型ヘム鉄を含む不活性型酵素と基質アルドキシムが安定な複合体を形成する性質を利用して、酸化型酵素基質複合体の単結晶も作製しました。大型放射光施設SPring-8の構造生物学Iビームライン(BL41XU)および理研構造生物学ビームラインII (BL44B2) (注:2009年5月より「理研 物質科学ビームライン」に名称を変更しています)において、結晶の可視光吸収スペクトルをモニターしながら超低温下で一定量のX線照射を行うことにより結晶中のヘム鉄を還元型 (活性型) に変換してから、X線回折実験を行いました。その結果、世界で初めて活性型Oxdの立体構造を原子レベルで解明しました。その立体構造は、8本のβストランドで形成されたβバレルをヘリックスが挟み、その隙間にヘム鉄が結合した新規な構造でした (図2)。基質アルドキシムは窒素原子を介してヘム鉄に結合するとともに、その近傍に存在するアミノ酸残基と水素結合を形成することにより触媒反応に適した位置に固定されていました (図3)。また基質の結合によってヘムの近くにある空間の形が大きく変化することが明らかになりました(図4)。すなわち、基質が結合していない時はこの空間はOxd分子を囲んでいる水溶液の領域につながっていますが、基質が結合するとこの水溶液の領域から遮断され、基質結合部位をより疎水的にすることにより脱水反応を促進することが示唆されました。
3. 今後の期待
OxdのX線結晶構造解析により「ヘム鉄の酸化状態の変化によって誘起される構造変化による酵素の活性制御」という、これまでに例のない新規な活性制御機構を解明できました。今後は、この特殊な酵素Oxdを利用したニトリル合成バイオプロセスの技術が確立されることによって、環境にやさしく低エネルギーコストでニトリルの製造を行うことが可能になると期待できます。
<参考資料>
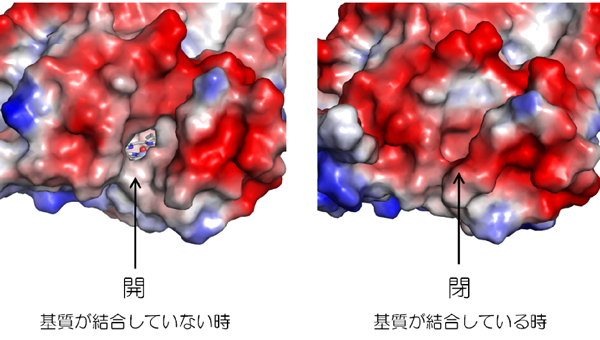 図4. 基質非結合型 (左)と基質結合型 (右) の分子表面の比較
図4. 基質非結合型 (左)と基質結合型 (右) の分子表面の比較 基質が結合していない時は、分子の表面から基質結合部位 (ヘム鉄周辺の空間)に続く穴が開いているが、基質が結合するとその穴が閉じる。分子表面の赤い部分は負電荷、青い部分は正電荷を帯びている。
<用語解説>
※1 ニトリル化合物
R-C≡Nで表される構造を持つ有機化合物の総称
※2 アルドキシム脱水酵素
R-C=N-OHで表されるアルドキシム化合物からニトリル化合物と水分子を生成する反応を触媒する酵素
※3 大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設。SPring-8の名前は、Super Photon ring-8Gevに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する、細くて強力な電磁波のこと。SPring-8ではこの放射光を用いて、ナノテクノロジー・バイオテクノロジー・産業利用まで幅広い研究がおこなわれている。
※4 X線結晶構造解析
波長の短いX線を、物質が規則正しく並んだ結晶に照射し、回折されたX線の強度を詳しく解析することにより、結晶内の分子構造を解析することができる。この方法により、多くの生体分子の立体構造が決定されている。
※5 ヘム
ポルフィリンと呼ばれる環状平面分子の中心に鉄原子をもつ化合物。ポルフィリン環の修飾の種類や位置によっていくつかの種類に分類される。ヘムを分子中に取り込んではじめてその機能が発揮されるタンパク質は通常赤い色をしていて、ヘムタンパク質と呼ぶ。酸素運搬体であるヘモグロビン、電子伝達に関与するシトクロム類、酵素活性をもつペルオキシダーゼなどがヘムタンパク質の代表例。
|
(問い合わせ先) 独立行政法人理化学研究所 独立行政法人理化学研究所 (SPring-8に関すること) |
- 現在の記事
- ニトリル合成を触媒するタンパク質の立体構造を解明-アルドキシム脱水酵素を活用した環境に優しいニトリル製造法の開拓に貢献-(トピック)
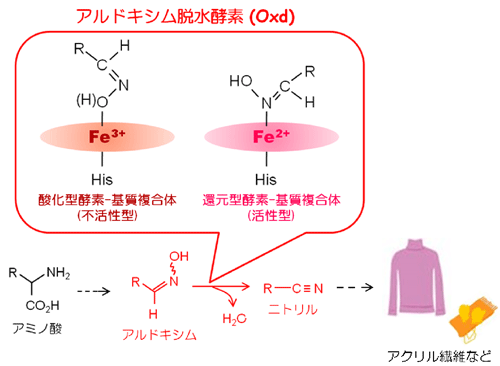 図1. 土壌細菌が有するアルドキシム-ニトリル代謝経路とOxd特有の活性制御機構
図1. 土壌細菌が有するアルドキシム-ニトリル代謝経路とOxd特有の活性制御機構 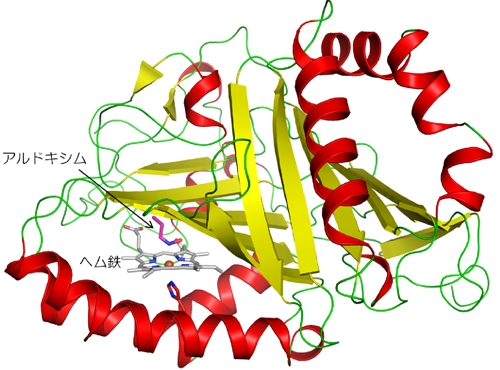 図2. Oxdの全体構造
図2. Oxdの全体構造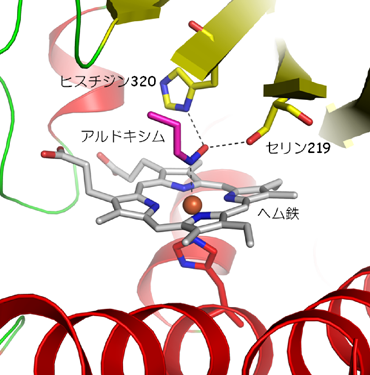 図3. 活性型酵素基質複合体の基質結合部位
図3. 活性型酵素基質複合体の基質結合部位