G-タンパク質共役受容体ロドプシンの立体構造を決定- 大型放射光施設(SPring-8)を用いて -(プレスリリース)
- 公開日
- 2000年08月03日
- BL45XU(理研 構造生物学I)
平成12年8月3日
理化学研究所
|
理化学研究所(小林俊一理事長)は、米国・ワシントン大学と共同で、世界で初めて7回膜貫通型レセプターであるG-タンパク質共役受容体、ウシ・ロドプシンの結晶構造解析に成功しました。当研究所の播磨研究所構造生物物理研究室の宮野雅司主任研究員らは、兵庫県播磨学園都市内にある大型放射光施設(SPring-8)の理研構造生物学Iビームライン(BL45XU)を用いて立体構造を決定しました。同ビームラインは、新規タンパク構造を効率的に解くためにMAD法に最適化されており、結晶の再現性が悪い条件下でも、唯一つの結晶から構造決定ができます。ロドプシンは、視覚組織である目の網膜にある視物質です。今回の構造決定によって、ロドプシンの視覚に関する機能や構造を明快に説明できるようになったばかりでなく、科学的にも応用上も最も重要なG-タンパク質共役受容体ファミリーの基本構造を明らかにしました。 |
1.背景
ロドプシンは、視覚組織である目の網膜にある視物質であり、最もよく研究されているG-タンパク質共役受容体です。ロドプシンは、生物において大切な視覚を司る環境情報センサーであり、数個の光子で活性化される極めて鋭敏な分子スイッチとして機能しています。
ロドプシンそのものとしても、もちろん極めて興味深い研究対象ですが、細胞信号伝達系の中心的タンパク質であるG-タンパク質共役受容体(GPCR)の一つとしても分子レベルの研究が進められてきました。GPCRは、種々のホルモン、神経伝達物質などの受容体として細胞の働き、運命を左右するスイッチとして働いています。このため、喘息に関与するヒスタミン受容体、エイズウィルス受容体CCR5などを含む最も大きなタンパク質のファミリーを形成し、基礎生物学はもちろん、医学的にも極めて重要です。このファミリー受容体をターゲットにした喘息薬、向精神薬など多くの医薬品の開発がなされ、現在も製薬企業による開発が活発に行なわれています。
これまで、電子顕微鏡によりカエルのロドプシンなどについて立体構造のおおよその形が明らかにされています。また同じ7回膜貫通型膜タンパク質で、機能の異なる細菌由来のロドプシンの構造をモデルとして研究が進められてきました。一方で、分光学、分子生物学、生化学、遺伝病理学など極めて多くの分野にまたがる研究が蓄積されてきています。今回の構造解析はこれらのすべてのGPCRの分子論的研究に対する新たな基盤となり、Scienceの査読者から「この分野における15年間の研究において最も重要な論文である」との評価を受けました。
2.研究成果
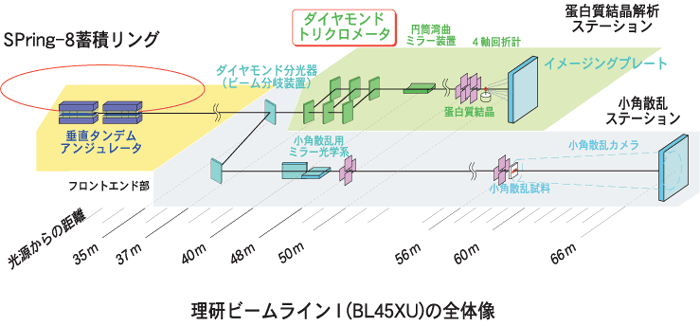
今回の構造解析は、ワシントン大学のパルチェフスキー教授のグループと、理研の宮野主任研究員のグループによる共同研究として進められました。構造解析に必要なロドプシンの結晶化は、ワシントン大学の岡田哲二研究員の5年以上にわたる地道な努力によって成し遂げられています。構造決定に当たっては、世界最高性能を誇る第3世代の大型放射光施設(SPring-8)が使用され、新規タンパク質構造を解くための多波長異常分散(MAD)法に最適化した理研構造生物学Iビームライン(BL45XU)を用いました。
ウシ・ロドプシンは膜タンパク質によく見られる通り、結晶化が困難であるばかりでなく、結晶の再現性が悪く質のよい結晶がたくさん必要となる従来の方法での位相決定が困難でした。そこで、理研ビームラインI (BL45XU)を使うことで、水銀でラベルしたただ一つのロドプシン結晶を用いて、6色でのデータ測定を精度よく行なうことができました。
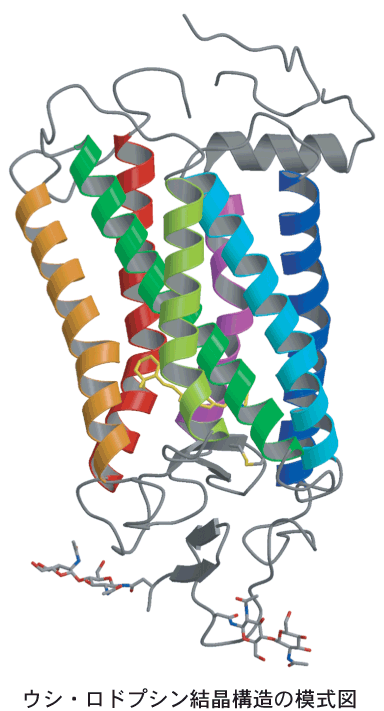
今回2.8Åの分解能で解析したウシ・ロドプシンの構造は、7回の膜貫通α-ヘリックスはもちろん、そのすぐ後に90度に曲がった短いα-へリックスがあること、細胞外の構造は4本のβ-シートを含めコンパクトに折りたたまれてており、2カ所に結合した糖鎖の一部も明瞭に見えました。このしっかりした構造は、多くのGPCRがホルモンなどが結合することでスイッチがオンとなる引き金になることに重要であろうと推察されます。7本の膜貫通ヘリックス内部での構造は、予想どおり、細菌由来のロドプシンと、7本のα-ヘリックスの並び方の基本は同じでしたが、それぞれの位置、形は大きく異なっており、機能の違いの現れであると理解できます。そして、視覚の病気と関係した突然変異は、多くがヘリックス間での水素結合など特異的相互作用をしている部分にあり、ロドプシンの構造維持や機能発現に重要であることが明らかにされました。
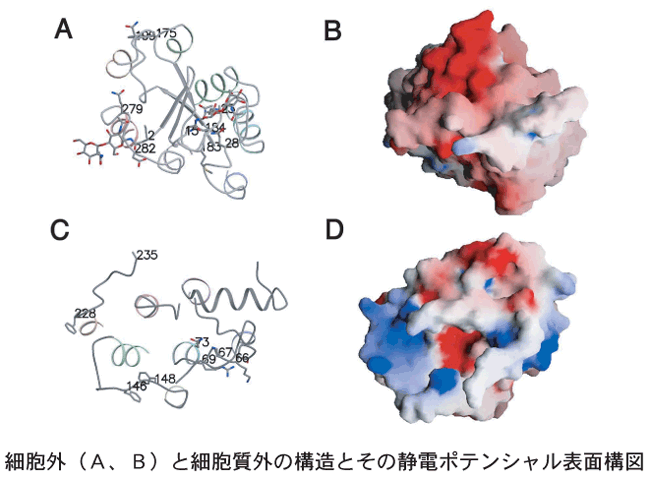
また、光を吸収してスイッチを入れるキーであるビタミンAの誘導体であるレチナールの構造とその環境は、これまでに明らかにされている多くの性質を明快に説明できたばかりでなく、色の識別に関わると見られるレチナール周辺の構造についても、これまで指摘されていなかった新たな研究の手がかりとなる情報が得られました。さらには、信号伝達に関わるG-タンパク質との結合部位のある細胞質側の構造もほとんど明らかにすることができました。この細胞質側の構造は、まさに分子スイッチとして働くGPCRであるロドプシンの分子機構を明らかにするための第一歩となるものであり、その表面構造、静電パターンの特徴的構造から具体的なスイッチ機構を予測することができます。
3.今後の展開
G-タンパク質共役受容体は、数百ものファミリータンパク質が知られている7回膜貫通型の受容体タンパク質であり、生物界において最も大きなファミリータンパク質の一つです。G-タンパク質共役受容体は、細胞の機能・分化を決定する生体内の信号伝達系において、ホルモンや神経伝達物質などのバラエティ豊かな結合分子に対する受容体として、その中心的役割を担っています。このため、G-タンパク質共役受容体は生物学的な興味の対象としてだけではなく、G-タンパク質共役受容体の作用を調整することで働く、喘息薬、向精神薬などの医薬品開発のターゲットとしても重要視されています。今回の結果は、これらの医薬品開発にも少なからず影響を与えるものと期待されています。
今回構造決定した光を吸収する前の「不活性型」ですが、ロドプシンは光を吸収して色素分子レチナールの構造を変えた後に、この変化がタンパク質の構造変化を引き起こして「活性型」に変化します。今後は、光によるロドプシンの活性化のメカニズムを構造解析によって明らかにするため、今回決定した光を吸収前の不活性型構造に続き、光吸収後の活性型構造を直接決めることを目指していきたいと考えています。
《参考資料》
PDF (640 kB)

PDF (216 kB)
PDF (888 kB)
PDF (88 kB)
|
<本研究に関する問い合わせ先> <SPring-8についての問い合わせ先> |
- 現在の記事
- G-タンパク質共役受容体ロドプシンの立体構造を決定- 大型放射光施設(SPring-8)を用いて -(プレスリリース)